كلورات الكالسيوم (Ca(ClO3)2) مركب كيميائي يتكون من الكالسيوم والكلور والأكسجين. ويشيع استخدامه كعامل مؤكسد في الألعاب النارية والمباريات. ويمكن استخدامه أيضًا لتعقيم المعدات في صناعة المواد الغذائية.
| اسم الأيوباك | كلورات الكالسيوم |
| الصيغة الجزيئية | الكالسيوم (ClO3)2 |
| CAS رقم | 10137-74-3 |
| المرادفات | حمض الكلوريك، ملح الكالسيوم. كلورات الكالسيوم المائية؛ بيركلورات الكالسيوم. كالسيوكلوريت. UN1456 |
| إنتشي | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
خصائص كلورات الكالسيوم
صيغة كلورات الكالسيوم
صيغة كلورات الكالسيوم هي Ca(ClO3)2. وهو يتألف من أيون Ca2+ واحد وأيونات ClO3-. كلورات الكالسيوم مركب أيوني، مما يعني أنه يرتبط ببعضه البعض عن طريق التجاذب الكهروستاتيكي بين الأيونات الموجبة والسالبة.
كلورات الكالسيوم الكتلة المولية
الكتلة المولية لـ Ca(ClO3)2 هي 206.98 جم/مول. ويمكن حساب ذلك عن طريق إضافة الكتل الذرية للكالسيوم والكلور والأكسجين التي يتكون منها المركب. الكتلة المولية مهمة لحساب كمية Ca(ClO3)2 اللازمة لتفاعل معين.
نقطة غليان كلورات الكالسيوم
Ca(ClO3)2 ليس له نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند تسخينه، يتحلل Ca(ClO3)2 إلى كلوريد الكالسيوم (CaCl2) وغاز الأكسجين (O2). هذا التحلل طارد للحرارة ويمكن أن يكون خطيرًا إذا لم يتم التعامل معه بشكل صحيح.
نقطة انصهار كلورات الكالسيوم
درجة انصهار Ca(ClO3)2 هي 135 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها المركب الصلب من الحالة الصلبة إلى الحالة السائلة. Ca(ClO3)2 مادة صلبة بلورية بيضاء عند درجة حرارة وضغط الغرفة.
كثافة كلورات الكالسيوم جم/مل
تبلغ كثافة Ca(ClO3)2 2.4 جم/مل. وهذا يعني أن الملليلتر الواحد من Ca(ClO3)2 يزن 2.4 جرام. الكثافة هي مقياس لكثافة الجزيئات في المادة. Ca(ClO3)2 أكثر كثافة من الماء، الذي تبلغ كثافته 1 جم/مل.
كلورات الكالسيوم الوزن الجزيئي
الوزن الجزيئي لـ Ca(ClO3)2 هو 206.98 جم/مول. وهي نفس الكتلة المولية ويمكن حسابها عن طريق إضافة الأوزان الذرية للعناصر الفردية في المركب.
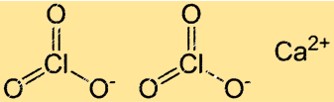
هيكل كلورات الكالسيوم
يحتوي Ca(ClO3)2 على بنية شبكية بلورية نموذجية للمركبات الأيونية. في هذا الهيكل، يتم ترتيب أيونات Ca2+ وClO3- بنمط منتظم ومتكرر. كل أيون Ca2+ محاط بستة أيونات ClO3- وكل أيون كلورات محاط بستة أيونات كالسيوم.
ذوبان كلورات الكالسيوم
Ca(ClO3)2 قابل للذوبان في الماء ويشكل محلول واضح عديم اللون. تزداد ذوبان Ca(ClO3)2 في الماء مع زيادة درجة الحرارة. ومع ذلك، فهو أقل قابلية للذوبان في المذيبات العضوية مثل الإيثانول والأسيتون. يعتبر Ca(ClO3)2 أيضًا استرطابيًا، مما يعني أنه يمتص الرطوبة من الهواء. هذا يمكن أن يجعل المركب رطبًا أو يذوب بمرور الوقت.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.4 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 206.98 جم/مول |
| كثافة | 2.4 جرام/مل |
| نقطة الانصهار | 135 درجة مئوية |
| نقطة الغليان | يتحلل قبل نقطة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء، وأقل قابلية للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر كلورات الكالسيوم
يعتبر Ca(ClO3)2 مادة خطرة ويجب التعامل معها بحذر. وهو عامل مؤكسد يمكن أن يتفاعل بعنف مع المواد العضوية، مما يسبب الحرائق والانفجارات. استنشاق أو ابتلاع الكالسيوم (ClO3)2 قد يسبب تهيج الجهاز التنفسي والجهاز الهضمي. قد يؤدي التعرض لفترة طويلة إلى تهيج الجلد والحروق وردود الفعل التحسسية المحتملة. من المهم ارتداء معدات الحماية الشخصية المناسبة عند التعامل مع Ca(ClO3)2، بما في ذلك القفازات والنظارات الواقية وجهاز التنفس الصناعي. إذا تعرضت، اطلب العناية الطبية على الفور. قم بتخزين Ca(ClO3)2 في مكان بارد وجاف وجيد التهوية بعيداً عن المواد غير المتوافقة.
| رموز الخطر | يا، اكس.ن |
| وصف الأمان | الابتعاد عن المواد العضوية. ارتداء معدات الحماية الشخصية. تخزينها في مكان بارد وجاف وجيد التهوية. |
| أرقام تعريف الأمم المتحدة | UN1458 |
| رمز النظام المنسق | 2829.11.00 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سام إذا تم ابتلاعه أو استنشاقه. قد يسبب تهيج الجلد والعين. قد يسبب تهيج الجهاز التنفسي. |
طرق تصنيع كلورات الكالسيوم
لتركيب Ca(ClO3)2، يمكننا استخدام طرق مختلفة.
تتضمن الطريقة الشائعة تفاعل هيدروكسيد الكالسيوم مع غاز الكلور. في هذه العملية، يتكون كلوريد الكالسيوم أولاً كمنتج ثانوي، والذي يتفاعل مع الكلور المتبقي لتكوين Ca(ClO3)2.
تتضمن الطريقة الأخرى تفاعل كربونات الكالسيوم مع حمض النيتريك وغاز الكلور. للحصول على Ca(ClO3)2، يتم تبخير المحلول الناتج وتبلوره.
هناك طريقة أخرى تتضمن التحليل الكهربائي لمحلول يحتوي على كلوريد الكالسيوم وكلورات الصوديوم. تنتج هذه العملية Ca(ClO3)2 وكلوريد الصوديوم كمنتج نهائي.
التفاعل بين هيبوكلوريت الكالسيوم وكلورات الصوديوم ينتج Ca(ClO3)2، والذي يتم بعد ذلك تنقيته وتبلوره.
استخدامات كلورات الكالسيوم
Ca(ClO3)2 له العديد من الاستخدامات الهامة في مختلف الصناعات. فيما يلي بعض التطبيقات الأكثر شيوعًا لـ Ca(ClO3)2:
- المبيض: يستخدم كعامل تبييض في صناعة اللب والورق.
- الألعاب النارية: عامل مؤكسد يستخدم عادة في إنتاج الألعاب النارية.
- أعواد الثقاب: تستخدم أيضًا في إنتاج أعواد الثقاب الآمنة، حيث يمكن إشعالها بسهولة.
- مبيدات الأعشاب: تستخدم كمبيد للأعشاب لأنها يمكن أن تقتل بشكل انتقائي بعض الأعشاب الضارة دون الإضرار بالمحاصيل.
- عامل مؤكسد: يستخدم كعامل مؤكسد في إنتاج مواد كيميائية أخرى، مثل البيركلورات والكلورات.
- الأدوية: تستخدم أيضًا في إنتاج المنتجات الصيدلانية، مثل الأدوية المضادة للعدوى.
- الكاشف المعملي: يستخدم ككاشف مختبري للكيمياء التحليلية.
- إنتاج الأصباغ: يستخدم في إنتاج الأصباغ مثل اللون الأزرق الفائق.
أسئلة:
س: ما هي صيغة كلورات الكالسيوم؟
ج: الصيغة الكيميائية لكلورات الكالسيوم هي Ca(ClO3)2.
س: ما هي استخدامات كلورات الكالسيوم؟
ج: Ca(ClO3)2 له تطبيقات مختلفة في الصناعات، مثل عامل التبييض في صناعة اللب والورق، والعامل المؤكسد في إنتاج المواد الكيميائية الأخرى، ومبيدات الأعشاب، وأصباغ الإنتاج والكواشف المختبرية.
س: هل كلورات الكالسيوم مادة صلبة؟
ج: نعم، Ca(ClO3)2 مادة صلبة في درجة حرارة الغرفة.
س: أين يوجد كلورات الصوديوم بشكل شائع وما هي استخدامات كلورات الكالسيوم؟
ج: يتم العثور على كلورات الصوديوم بشكل شائع في الصناعة الكيميائية، حيث يتم استخدامها كعامل مؤكسد ومبيدات الأعشاب. ومن ناحية أخرى، يستخدم Ca(ClO3)2 كعامل تبييض وعامل مؤكسد ومبيدات أعشاب في مختلف الصناعات.
س: ما هو إجمالي عدد الذرات الموجودة في المركب Ca(ClO3)2؟
ج: يحتوي المركب Ca(ClO3)2 على إجمالي 13 ذرة: 1 ذرة كالسيوم، و2 ذرات كلور، و6 ذرات أكسجين من أيوني ClO3-.
س: ما النسبة المئوية لكتلة الكلور في Ca(ClO3)2؟
ج: الكتلة الذرية للكلور هي 35.5 جم/مول، والكتلة المولية لـ Ca(ClO3)2 هي 238.98 جم/مول. لذلك، فإن نسبة كتلة الكلور في Ca(ClO3)2 هي (2 × 35.5 جم/مول) / 238.98 جم/مول × 100% = 29.68%.
س: ما عدد ذرات الكلور الموجودة في Ca(ClO3)2؟
ج: هناك ذرتان من الكلور في Ca(ClO3)2، ممثلتين بمجموعتي ClO3.
س: ما كتلة كل مركب في الخليط الأصلي Ca(ClO3)2 وCa(ClO)2؟
ج: من المستحيل تحديد كتلة كل مركب في الخليط الأصلي دون معلومات إضافية مثل الكتلة الكلية أو نسبة الكتلة بين المركبين.
