كربونات الليثيوم (Li2CO3) هو مركب أساسي يستخدم في أدوية تثبيت المزاج. يعالج الاضطراب ثنائي القطب ويساعد على إدارة الاكتئاب بشكل فعال، وبالتالي تعزيز الصحة العقلية العامة.
| اسم الأيوباك | كربونات الليثيوم |
| الصيغة الجزيئية | Li2CO3 |
| CAS رقم | 554-13-2 |
| المرادفات | كربونات الديليثيوم. حمض الكربونيك، ملح الديليثيوم؛ كربونات الليثيوم (1+)؛ حمض الكربونيك، ملح الليثيوم (1:1) |
| إنتشي | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
خصائص كربونات الليثيوم
صيغة كربونات الليثيوم
صيغة كربونات الديليثيوم هي Li2CO3. وهذا يعني أن كل جزيء يحتوي على ذرتي ليثيوم (Li)، وذرة كربون واحدة (C) وثلاث ذرات أكسجين (O). يلعب هذا التركيب الكيميائي دورًا حاسمًا في خصائصه وتطبيقاته.
الكتلة المولية لكربونات الليثيوم
تبلغ الكتلة المولية لكربونات الديليثيوم حوالي 73.89 جم / مول. ويتم حسابه عن طريق إضافة الكتل الذرية للعناصر المكونة له، مع الأخذ في الاعتبار نسب كل منها في الصيغة. هذه القيمة ضرورية لمختلف الحسابات والتفاعلات الكيميائية التي تشمل كربونات الديليثيوم.
نقطة غليان كربونات الليثيوم
تتمتع كربونات الديليثيوم بنقطة غليان عالية، تبلغ عادة حوالي 1310 درجة مئوية (2390 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب من السائل إلى الغاز، مما يجعله مناسبًا لعمليات وتطبيقات صناعية محددة.
نقطة انصهار كربونات الليثيوم
تتمتع كربونات الديليثيوم بنقطة انصهار منخفضة نسبيًا، عادةً حوالي 720 درجة مئوية (1328 درجة فهرنهايت). عند درجة الحرارة هذه، يتغير المركب من الحالة الصلبة إلى الحالة السائلة، مما يسهل استخدامه في صناعة السيراميك والزجاج وغيرها من المواد.
كثافة كربونات الليثيوم جم / مل
تبلغ كثافة كربونات الديليثيوم حوالي 2.11 جم / مل. تمثل هذه القيمة كتلته لكل وحدة حجم، مما يشير إلى مدى إحكام تماسك الجزيئات معًا. تعد كثافة كربونات الديليثيوم أمرًا بالغ الأهمية لفهم خصائصها الفيزيائية وسلوكها.
الوزن الجزيئي لكربونات الليثيوم
يبلغ الوزن الجزيئي لكربونات الديليثيوم حوالي 73.89 جم / مول. تتوافق هذه القيمة مع كتلة مول واحد من المركب وهي ضرورية في الحسابات الكيميائية المختلفة، مثل تحديد عدد المولات في كمية معينة من المادة.
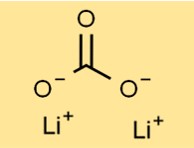
هيكل كربونات الليثيوم
تحتوي كربونات الديليثيوم على بنية بلورية تشكل مسحوقًا أبيض عديم الرائحة. يتكون ترتيبها من كاتيونات Li+ وأنيونات الكربونات (CO3^2-) المرتبطة معًا بواسطة روابط أيونية. يساهم هذا الترتيب المحدد في استقرار وتفاعلية المركب.
ذوبان كربونات الليثيوم
كربونات الديليثيوم لها قابلية محدودة للذوبان في الماء. يذوب إلى حد ما، ويشكل محلول قلوي قليلاً. تعد قابلية ذوبان كربونات الديليثيوم أحد الاعتبارات الحاسمة في التركيبات الصيدلانية والتطبيقات الأخرى التي تتطلب الذوبان المتحكم فيه.
| مظهر | مسحوق أبيض عديم الرائحة |
| جاذبية معينة | 2.11 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 73.89 جرام/مول |
| كثافة | 2.11 جم/مل |
| نقطة الانصهار | 720 درجة مئوية (1328 درجة فهرنهايت) |
| نقطة الغليان | 1310 درجة مئوية (2390 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ذوبان محدود |
| الذوبان | قابل للذوبان في الماء، وتشكيل محلول قلوي قليلا |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | قلوية قليلا |
السلامة ومخاطر كربونات الليثيوم
تشكل كربونات الديليثيوم مخاطر محتملة على السلامة تتطلب معالجة دقيقة. الاتصال المباشر مع الجلد قد يسبب تهيجًا، في حين أن الابتلاع قد يؤدي إلى إزعاج في الجهاز الهضمي. في حالة التعرض المفرط، يمكن أن يؤدي إلى تأثيرات ضارة على الجهاز العصبي. وينبغي اتباع احتياطات السلامة المناسبة، مثل ارتداء معدات الحماية، عند التعامل معها لتجنب المخاطر المحتملة. من الضروري تخزين ونقل كربونات الديليثيوم بعيدًا عن المواد ومصادر الحرارة أو اللهب غير المتوافقة. في حالات الطوارئ، اطلب العناية الطبية على الفور. يجب مراجعة أوراق بيانات السلامة والمبادئ التوجيهية بعناية واتباعها عند العمل مع كربونات الديليثيوم.
| رموز الخطر | تآكل، مهيج |
| وصف الأمان | قد يسبب تهيجا. تجنب تناوله. استخدم مع التهوية الكافية. ارتداء معدات الحماية. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2836.40.00 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير مصنف |
| تسمم | سمية منخفضة |
طرق تصنيع كربونات الليثيوم
توجد طرق مختلفة لتصنيع كربونات الديليثيوم.
يتمثل النهج الشائع في إخضاع مركبات الليثيوم، مثل هيدروكسيد الليثيوم أو أكسيد الليثيوم، لثاني أكسيد الكربون تحت ظروف خاضعة للرقابة. ينتج عن التفاعل كربونات الليثيوم والماء كمنتج ثانوي. تتضمن الطريقة الأخرى خلط أملاح الليثيوم القابلة للذوبان، مثل كلوريد الليثيوم، مع مركب كربونات قابل للذوبان. ويشكل التفاعل راسبًا صلبًا من كربونات الليثيوم، والتي يمكن للباحثين فصلها وجمعها.
بالإضافة إلى ذلك، من الممكن إنتاج كربونات الديليثيوم عن طريق التحلل الحراري لبيكربونات الليثيوم. عندما يتم تسخين بيكربونات الليثيوم، فإنه يتحلل إلى كربونات الليثيوم، ويطلق ثاني أكسيد الكربون والماء. تستخدم بعض الأماكن الصناعية هذه العملية للحصول على كربونات الليثيوم عالية النقاء.
لتحقيق النتائج ومستويات النقاء المطلوبة، بغض النظر عن الطريقة المستخدمة، يجب عليهم ضمان التحكم المناسب في معلمات التفاعل، مثل درجة الحرارة والضغط وقياس العناصر الكيميائية. يلعب تخليق كربونات الديليثيوم دورًا حيويًا في إنتاج هذا المركب لمختلف التطبيقات، بما في ذلك الأدوية والسيراميك والبطاريات.
استخدامات كربونات الليثيوم
تجد كربونات الديليثيوم تطبيقات مختلفة بسبب خصائصها الفريدة. فيما يلي استخداماته الرئيسية:
- المستحضرات الصيدلانية: يعد عنصراً أساسياً في أدوية تثبيت المزاج، وعلاج اضطراب ثنائي القطب والاكتئاب بشكل فعال وتعزيز الصحة العقلية.
- البطاريات: في بطاريات الليثيوم أيون القابلة لإعادة الشحن، تعمل كربونات الديليثيوم كمقدمة لمركبات الليثيوم وتلعب دورًا حاسمًا في تقنيات تخزين الطاقة.
- الألعاب النارية: إن التفاعل الطارد للحرارة لكربونات الديليثيوم مع بعض المواد الكيميائية يجعلها ذات قيمة في الألعاب النارية والمشاعل.
- التخليق الكيميائي: كمصدر لأيونات الليثيوم، فهو ضروري في التفاعلات الكيميائية المختلفة والتوليفات العضوية.
- مصدر الفلزات القلوية: يعمل كمصدر لليثيوم في المختبرات والأبحاث، ويستخدم لدراسة خواص الفلزات القلوية.
- التطبيقات البيئية: تساعد كربونات الديليثيوم على تنظيم درجة الحموضة في عمليات معالجة المياه، والتحكم في الحموضة والقلوية.
- السيراميك والزجاج: تعمل كربونات الديليثيوم على تحسين ثبات منتجات السيراميك والزجاج من خلال العمل كعامل تدفق، وبالتالي تقليل درجات حرارة الانصهار.
- علم المعادن: في علم المعادن، تقوم كربونات الديليثيوم بتكرير المعادن مثل الألومنيوم والنحاس، مما يؤدي إلى إزالة الشوائب بشكل فعال وتحسين خواصها الميكانيكية.
- تكييف الهواء: تستخدم المجففات في أنظمة تكييف الهواء كربونات الديليثيوم لامتصاص الرطوبة بشكل فعال، مما يضمن الأداء الأمثل لتكييف الهواء.
بشكل عام، تسلط المجموعة الواسعة من تطبيقات كربونات الديليثيوم الضوء على أهميتها عبر الصناعات، مما يجعلها مركبًا قيمًا في التكنولوجيا الحديثة والطب وعلوم المواد.
أسئلة:
س: أي العناصر التالية يحتوي على أقل عدد من إلكترونات التكافؤ؟
ج: يحتوي البريليوم على أقل عدد من إلكترونات التكافؤ، حيث يحتوي على إلكترونين فقط.
س: ما هو استخدام كربونات الليثيوم؟
ج: تستخدم كربونات الديليثيوم في أدوية تثبيت المزاج لعلاج الاضطراب الثنائي القطب والاكتئاب.
س: هل كربونات الديليثيوم قابلة للذوبان؟
ج: نعم، كربونات الديليثيوم قابلة للذوبان في الماء بدرجة محدودة.
س: كيف تعمل كربونات الليثيوم؟
ج: تعمل كربونات الديليثيوم على استقرار الحالة المزاجية وموازنة الناقلات العصبية في الدماغ.
س: ماذا تعالج كربونات الليثيوم؟
ج: تستخدم كربونات الديليثيوم لعلاج الاضطراب ثنائي القطب والاكتئاب في الطب النفسي.
س: هل LiNO3 أيوني أم تساهمي؟
ج: LiNO3 أيوني.
س: أي مما يلي غير قابل للذوبان في الماء؟ Li2CO3، NaOH، PbCl2، Ba(OH)2، (NH4)2S.
ج: PbCl2 وBa(OH)2 غير قابلين للذوبان في الماء.
س: هل Li2CO3 قابل للذوبان في الماء؟
ج: Li2CO3 قليل الذوبان في الماء.
س: ما عدد الأيونات الموجودة في Li2CO3؟
ج: يحتوي Li2CO3 على ثلاثة أيونات: أيونان Li+ وواحد CO3^2- أيون.
س: ما عدد وحدات الصيغة الموجودة في 0.0067 جم من Li2CO3؟
ج: يوجد ما يقرب من 1.24 × 10^20 وحدة صيغة في 0.0067 جم من Li2CO3.
س: ما عدد أيونات الليثيوم الموجودة في 30.0 مل من محلول Li2CO3 بتركيز 0.600 مولار؟
ج: يوجد 0.036 مول من أيونات Li+ في 30.0 مل من محلول 0.600 مولار Li2CO3.
س: ما النسبة المئوية لتركيب الكربون في كربونات الليثيوم Li2CO3؟
ج: تبلغ نسبة كتلة الكربون في Li2CO3 حوالي 11.3%.
س: أي أزواج المحاليل المائية التالية سيشكل راسبًا عند خلط NH4NO3 + Li2CO3؟
ج: لن يشكل NH4NO3 + Li2CO3 راسبًا لأن كلا المركبين قابلان للذوبان في الماء.
