كربونات الزنك (ZnCO3) هي مادة صلبة بيضاء اللون عديمة الرائحة، تتشكل نتيجة تفاعل الزنك مع أيونات الكربونات. يتم استخدامه في تطبيقات مختلفة، مثل السيراميك والمستحضرات الصيدلانية، وذلك بسبب خصائصه الفريدة.
| اسم الأيوباك | كربونات الزنك |
| الصيغة الجزيئية | أكسيد الزنك3 |
| CAS رقم | 3486-35-9 |
| المرادفات | كربونات الزنك (II)؛ سميثسونيت. الزنك المكربن؛ كربونات الزنك |
| إنتشي | InChI=1S/CH2O3.Zn/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
خصائص كربونات الزنك
صيغة كربونات الزنك
الصيغة الكيميائية لكربونات الزنك هي ZnCO3. وتتكون من ذرة زنك واحدة (Zn)، وذرة كربون واحدة (C) وثلاث ذرات أكسجين (O). هذا المركب عبارة عن مادة صلبة بيضاء عديمة الرائحة ويوجد عادة في الطبيعة مثل معدن سميثسونيت.
كربونات الزنك الكتلة المولية
يمكن حساب الكتلة المولية لكربونات الزنك عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يحتوي الزنك على كتلة مولية تبلغ حوالي 65.38 جم / مول، والكربون 12.01 جم / مول، والأكسجين 16.00 جم / مول (تقريبًا). وبالتالي، فإن الكتلة المولية لكربونات الزنك تبلغ حوالي 125.38 جم/مول.
درجة غليان كربونات الزنك
ليس لكربونات الزنك نقطة غليان مميزة لأنها تتحلل عند تسخينها، وتطلق ثاني أكسيد الكربون وتترك وراءها أكسيد الزنك (ZnO). ومع ذلك، فهو مستقر حتى درجات حرارة حوالي 300 درجة مئوية.
نقطة انصهار كربونات الزنك
تبلغ نقطة انصهار كربونات الزنك حوالي 333 درجة مئوية (تقريبًا). عند درجة الحرارة هذه، تخضع كربونات الزنك للتحلل الحراري وتشكل أكسيد الزنك وثاني أكسيد الكربون.
كثافة كربونات الزنك جم/مل
تبلغ كثافة كربونات الزنك حوالي 4.398 جم / مل (تقريبًا). تشير هذه القيمة إلى أن كربونات الزنك مادة صلبة كثيفة نسبيًا مقارنة بالعديد من المركبات الأخرى.
الوزن الجزيئي لكربونات الزنك
يبلغ الوزن الجزيئي لكربونات الزنك، والذي يُسمى أيضًا الكتلة المولية، حوالي 125.38 جم/مول. وهي كتلة مول واحد من جزيئات كربونات الزنك، وتستخدم في الحسابات الكيميائية المختلفة.
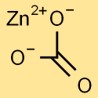
هيكل كربونات الزنك
تحتوي كربونات الزنك على بنية بلورية ثلاثية الزوايا. كاتيون الزنك (Zn2+) محاط بأنيونات الكربونات (CO32-) في ترتيب مستو ثلاثي. يمنح هذا الترتيب كربونات الزنك خصائصه الفيزيائية والكيميائية الفريدة.
ذوبان كربونات الزنك
كربونات الزنك ضعيفة الذوبان في الماء. تنخفض قابليته للذوبان مع انخفاض درجة الحرارة وزيادة الرقم الهيدروجيني. يمكن أن يذوب أيضًا في المحاليل الحمضية بسبب تكوين أملاح الزنك القابلة للذوبان. ومع ذلك، فإنه يشكل رواسب غير قابلة للذوبان في وجود الكربونات أو الهيدروكسيدات.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 4,398 جم/مل (تقريبًا) |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 125.38 جرام/مول |
| كثافة | 4,398 جم/مل (تقريبًا) |
| نقطة الانصهار | 333 درجة مئوية (تقريبًا) |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ضعيف الذوبان |
| الذوبان | غير قابل للذوبان في معظم المذيبات، ويمكن أن يذوب أيضًا في المحاليل الحمضية |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | قلوية قليلاً (حوالي 8-9) |
سلامة ومخاطر كربونات الزنك
تشكل كربونات الزنك بعض مخاطر السلامة التي تتطلب اهتمامًا خاصًا. قد يهيج الجلد والعينين والجهاز التنفسي عن طريق الاتصال أو الاستنشاق. تجنب تناوله لأن ذلك قد يسبب اضطرابًا في الجهاز الهضمي. عند التعامل، قم بارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، لتجنب الاتصال المباشر. قم بتخزين كربونات الزنك في مكان بارد وجاف بعيداً عن المواد غير المتوافقة. في حالة الابتلاع أو التعرض العرضي، اطلب العناية الطبية على الفور. بالإضافة إلى ذلك، اتبع إجراءات التخلص المناسبة من النفايات لهذا المركب لتقليل التأثير البيئي. تعد ممارسات المعالجة والتخزين المناسبة ضرورية لضمان الاستخدام الآمن لكربونات الزنك في التطبيقات المختلفة.
| رموز الخطر | لا أحد |
| وصف الأمان | ضار إذا ابتلع أو استنشق. مهيجة للبشرة والعينين. تجنب الاتصال. استخدم مع التهوية الكافية. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 28369900 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة إلى متوسطة |
طرق تصنيع كربونات الزنك
يمكن تصنيع كربونات الزنك بطرق مختلفة. الطريقة الشائعة هي تفاعل أكسيد الزنك (ZnO) مع ثاني أكسيد الكربون (CO2) في وجود الماء أو مذيب مناسب. يمكن إجراء التفاعل عند درجة حرارة وضغط يمكن التحكم فيهما لتعزيز تكوين كربونات الزنك.
تتضمن الطريقة الأخرى تفاعل كلوريد الزنك (ZnCl2) أو كبريتات الزنك (ZnSO4) مع كربونات الصوديوم (Na2CO3) أو كربونات البوتاسيوم (K2CO3) في محلول مائي. تعمل هذه العملية على تكوين كربونات الزنك على شكل راسب، والذي يمكن فصله وجمعه.
بالإضافة إلى ذلك، يمكن الحصول على كربونات الزنك عن طريق كربنة هيدروكسيد الزنك (Zn(OH)2) أو أكسيد الزنك مع ثاني أكسيد الكربون، إما في صورة غازية أو مذابة في الماء.
في البيئات الصناعية، غالبًا ما يتم إنتاج كربونات الزنك كمنتج ثانوي لمعالجة الزنك أو نتيجة للتفاعلات التي تتضمن مواد تحتوي على الزنك.
من الضروري ضمان قياس العناصر الكيميائية الصحيحة وظروف التفاعل أثناء التوليف للحصول على منتج نقي وعالي الجودة. يعتمد اختيار الطريقة على عوامل مثل توفر الكواشف، والنقاء المطلوب للمنتج، والاستخدام المقصود لكربونات الزنك.
استخدامات كربونات الزنك
تجد كربونات الزنك تطبيقات مختلفة في مختلف الصناعات بسبب خصائصها الفريدة. فيما يلي بعض الاستخدامات البارزة:
- السيراميك: تعمل كربونات الزنك على خفض درجة انصهار المواد بشكل فعال وتحسين لمعانها وشفافيتها عند استخدامها كعامل تدفق في طلاء السيراميك.
- المستحضرات الصيدلانية: في التطبيقات الطبية، تعمل كربونات الزنك كعنصر نشط في بعض التركيبات المطهرة والقابضة.
- الدهانات: تعمل كربونات الزنك كصبغة بيضاء في الدهانات والطلاءات، مما يوفر لمعانًا وقوة إخفاء ممتازة.
- صناعة المطاط: في عملية الفلكنة، تعمل كربونات الزنك كمسرع، مما يعمل بشكل فعال على تحسين الخواص الميكانيكية للمنتجات المطاطية.
- صناعة النسيج: باعتبارها مادة لاذعة، تعمل كربونات الزنك بشكل فعال على تحسين الاحتفاظ بالأصباغ على الأقمشة أثناء عملية الصباغة.
- الإلكترونيات: تجد كربونات الزنك تطبيقًا نشطًا في المكونات الإلكترونية وكمادة طلاء لأشباه الموصلات، وذلك بفضل خصائصها الكهربائية.
- الزراعة: تعمل كربونات الزنك بشكل فعال كمبيد للفطريات ووقائي للعفن للمحاصيل.
- صناعة الزجاج: في عملية صناعة الزجاج، تعمل كربونات الزنك كعامل تدفق، مما يقلل بشكل فعال من نقطة انصهار الزجاج ويحسن نقاءه.
- إضافات الأعلاف الحيوانية: يضيف المصنعون كربونات الزنك إلى علف الحيوانات كمصدر حاسم للزنك الأساسي، الذي يدعم بشكل فعال الصحة العامة للماشية.
- معالجة المياه: تستخدم مرافق معالجة المياه كربونات الزنك بشكل فعال في عملياتها للتحكم بفعالية في مستويات الرقم الهيدروجيني وإزالة الشوائب المعدنية الثقيلة بشكل فعال.
إن تعدد استخدامات كربونات الزنك في مختلف الصناعات يسلط الضوء على أهميته كمركب قيم مع مجموعة واسعة من التطبيقات العملية.
أسئلة:
س: هل ZnCO3 قابل للذوبان في الماء؟
ج: كربونات الزنك ضعيفة الذوبان في الماء.
س: ما التفاعل الذي من المرجح أن يحدث؟ حزب العمال + FeCl3 Mn + CaO Li + ZnCO3 Cu + 2KNO3
ج: التفاعل الأكثر احتمالاً هو Li + ZnCO3.
س: ما كتلة ZnCO3 التي تحتوي على 3.11×10^22 ذرات؟
ج: يمكن حساب كتلة ZnCO3 التي تحتوي على 3.11×10^22 ذرات O بناءً على الكتلة المولية وقياس العناصر الكيميائية للمركب.
س: ما هو اسم ZnCO3؟
ج: اسم ZnCO3 هو كربونات الزنك.
س: أي المركبات التالية يذوب في الماء؟ Cu3(PO4)2، CoS، Pb(NO3)2، ZnCO3؟
ج: ZnCO3 قليل الذوبان في الماء.
س: ما نوع الرابطة التي تتشكل بين ZnCO3؟
ج: تتكون الروابط الأيونية بين ZnCO3.
س: هل كربونات الزنك قابلة للذوبان في الماء؟
ج: كربونات الزنك ضعيفة الذوبان في الماء.
س: ما هي بطارية الكربون والزنك؟
ج: بطارية الكربون والزنك هي نوع من البطاريات الجافة التي تستخدم أنود الزنك وكاثود الكربون مع معجون إلكتروليتي.
س: كيف تختلف البطارية القلوية عن خلية الزنك والكربون الجافة؟
ج: تتمتع البطاريات القلوية بكثافة طاقة أعلى وعمر أطول من الخلايا الجافة المصنوعة من الزنك والكربون بسبب استخدام المنحل بالكهرباء القلوي.
س: ما الفرق بين بطاريات الكربون والزنك والبطاريات القلوية؟
ج: تتمتع بطاريات الكربون والزنك بقدرة طاقة أقل وعمر افتراضي أقصر من البطاريات القلوية بسبب الاختلافات في الإلكتروليت والبناء.
س: هل يمكنك استخدام بطاريات الكربون والزنك بدلاً من البطاريات القلوية؟
ج: نعم، ولكن قد يكون عمر بطاريات الكربون والزنك أقصر وتكون أقل ملاءمة للأجهزة ذات الاستنزاف العالي من البطاريات القلوية.
