كربونات البوتاسيوم (K2CO3) عبارة عن مسحوق أبيض عديم الرائحة يستخدم عادة في إنتاج الصابون والزجاج والسيراميك. ويمكن استخدامه أيضًا كعامل مضاف للأغذية وعامل تخزين مؤقت في صناعة الأدوية.
| اسم الأيوباك | كربونات البوتاسيوم |
| الصيغة الجزيئية | K2CO3 |
| CAS رقم | 584-08-7 |
| المرادفات | حمض الكربونيك، ملح ثنائي البوتاسيوم. رماد اللؤلؤ البوتاس. ملح الجير كربونات البوتاسيوم؛ كربونات هيدروجين البوتاسيوم |
| إنتشي | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; م |
خصائص كربونات البوتاسيوم
صيغة كربونات البوتاسيوم
الصيغة الكيميائية لكربونات البوتاسيوم هي K2CO3. تمثل هذه الصيغة العدد الدقيق لذرات كل عنصر في المركب. يمكن استخدام الصيغة لحساب الكتلة المولية وخصائص المركب الأخرى.
كربونات البوتاسيوم الكتلة المولية
K2CO3 لديه كتلة مولية تبلغ 138.21 جم / مول. وهذا يعني أن المول الواحد من K2CO3 يحتوي على 138.21 جرامًا من المركب. الكتلة المولية مهمة في تحديد كمية المادة اللازمة لتفاعل أو تجربة معينة. كما أنها تستخدم لتحويل الكتلة إلى مولات المادة.
نقطة غليان كربونات البوتاسيوم
K2CO3 لديه نقطة غليان عالية نسبيًا تبلغ 1620 درجة مئوية (2948 درجة فهرنهايت). وهذا يجعلها مفيدة في تطبيقات درجات الحرارة العالية مثل إنتاج الزجاج والسيراميك. نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من سائل إلى غاز.
نقطة انصهار كربونات البوتاسيوم
K2CO3 لديه نقطة انصهار تبلغ 891 درجة مئوية (1636 درجة فهرنهايت). ترجع نقطة الانصهار المرتفعة نسبيًا إلى الطبيعة الأيونية للمركب. عند تسخينها، يجب كسر الروابط الأيونية بين أيونات البوتاسيوم والكربونات حتى تذوب المادة.
كثافة كربونات البوتاسيوم جم/مل
تبلغ كثافة K2CO3 2.43 جم / مل عند درجة حرارة الغرفة. وهذا يعني أن حجمًا معينًا من K2CO3 له كتلة معينة. تعد كثافة المادة خاصية مهمة يمكن استخدامها لتحديد المادة وحساب كتلة أو حجم المادة في مساحة معينة.
الوزن الجزيئي لكربونات البوتاسيوم
الوزن الجزيئي لـ K2CO3 هو 138.21 جم / مول. هذه هي كتلة مول واحد من المركب، وهو أمر مهم في العديد من الحسابات الكيميائية.
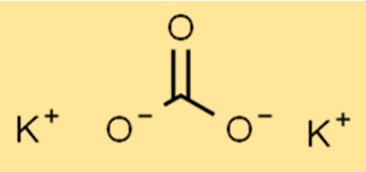
هيكل كربونات البوتاسيوم
يحتوي K2CO3 على بنية أيونية، مع الصيغة K2CO3. يرتبط أيون البوتاسيوم (K+) وأيون الكربونات (CO32-) معًا بواسطة روابط أيونية. أيون الكربونات هو أيون متعدد الذرات يتكون من ذرة كربون واحدة وثلاث ذرات أكسجين.
| مظهر | مسحوق بلوري أبيض |
| كثافة محددة | 2.43 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 138.21 جرام/مول |
| كثافة | 2.43 جرام/مل |
| نقطة الانصهار | 891 درجة مئوية (1636 درجة فهرنهايت) |
| نقطة الغليان | 1620 درجة مئوية (2948 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 112 جم/100 مل عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الماء والجلسرين والكحول |
| ضغط البخار | لا يكاد يذكر في درجة حرارة الغرفة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 10:33 صباحًا |
| الرقم الهيدروجيني | 11.5 (محلول مائي 10 جم/لتر) |
سلامة ومخاطر كربونات البوتاسيوم
يعتبر K2CO3 بشكل عام آمنًا للاستخدام في الصناعة والمنتجات المنزلية. ومع ذلك، قد يكون مهيجًا للجلد والعينين، كما أن استنشاق المسحوق قد يسبب تهيجًا في الجهاز التنفسي. التعرض لفترات طويلة لتركيزات عالية من غبار K2CO3 يمكن أن يسبب تلف الرئة. من المهم ارتداء معدات الحماية الشخصية المناسبة عند التعامل مع هذا المركب، بما في ذلك القفازات والنظارات الواقية والقناع. K2CO3 ليس قابلاً للاشتعال أو الانفجار، ولكنه يمكن أن يتفاعل مع الأحماض لإنتاج ثاني أكسيد الكربون، والذي يمكن أن يكون خطيرًا في الأماكن الضيقة. في حالة ابتلاعه أو ملامسته للجلد أو العينين، اطلب العناية الطبية على الفور.
| رموز الخطر | لا أحد |
| وصف الأمان | ارتداء القفازات والنظارات الواقية والقناع. تجنب ملامسة الجلد والعينين لفترة طويلة. لا تستنشق المسحوق. |
| أرقام تعريف الأمم المتحدة | UN1863 |
| رمز النظام المنسق | 2836.40.00 |
| فئة الخطر | ليست خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | لا تعتبر كربونات البوتاسيوم سامة، ولكنها يمكن أن تسبب تهيج الجهاز التنفسي والجلد بتركيزات عالية. التعرض لفترات طويلة لتركيزات عالية من الغبار يمكن أن يسبب تلف الرئة. |
طرق تصنيع كربونات البوتاسيوم
يمكن لطرق مختلفة تصنيع K2CO3
الطريقة الشائعة هي تفاعل هيدروكسيد البوتاسيوم مع ثاني أكسيد الكربون.
ولمنع هروب ثاني أكسيد الكربون، يمكن إجراء هذا التفاعل في حاوية مغلقة.
تتضمن الطريقة الأخرى تفاعل كلوريد البوتاسيوم مع كربونات الصوديوم في محلول مائي. يترسب K2CO3 الناتج خارج المحلول ويمكن جمعه عن طريق الترشيح.
هناك طريقة أخرى لتصنيع K2CO3 وهي تفاعل كبريتات البوتاسيوم مع الكربون في وجود الفحم. تاريخيًا، استخدم الكيميائيون عملية لوبلانك لإنتاج K2CO3 على نطاق صناعي. ومع ذلك، فإن المخاوف البيئية جعلت هذه العملية نادرة اليوم، لأنها تطلق ثاني أكسيد الكبريت.
يمكن تصنيع K2CO3 من بيكربونات البوتاسيوم عن طريق تسخينه إلى درجات حرارة عالية، مما يؤدي إلى تحلله إلى K2CO3 وثاني أكسيد الكربون. يمكن للفرن أو الفرن إجراء هذا التفاعل.
استخدامات كربونات البوتاسيوم
لدى K2CO3 مجموعة واسعة من التطبيقات في مختلف الصناعات بسبب خصائصه الفريدة. بعض استخداماته الشائعة تشمل:
- إنتاج الزجاج: يستخدم كتدفق لخفض درجة انصهار السيليكا والمكونات الأخرى.
- صناعة المواد الغذائية: يستخدم كمضاف غذائي لتنظيم الحموضة وكعامل ترك في الخبز.
- الصابون والمنظفات: يستخدم أيضاً في صناعة الصابون والمنظفات كمنقي للمياه.
- الصناعة الصيدلانية: يستخدم كعامل تخزين مؤقت في تركيب الأدوية.
- الأسمدة: يستخدم أيضاً كسماد في الزراعة لتوفير البوتاسيوم للنباتات.
- إنتاج السيراميك: يستخدم كتدفق لتقليل درجة حرارة الحرق وتحسين جودة المنتج النهائي.
- الألعاب النارية: تستخدم في إنتاج الألعاب النارية لإنتاج لهب أرجواني.
- البطاريات: تستخدم في إنتاج البطاريات كمحلول كهربائي.
- صناعة النسيج: تستخدم كعامل صباغة.
أسئلة:
س: هل كربونات البوتاسيوم قابلة للذوبان؟
ج: نعم، كربونات البوتاسيوم قابلة للذوبان في الماء.
س: هل K2CO3 قابل للذوبان في الماء؟
ج: نعم، K2CO3 قابل للذوبان في الماء. في الواقع، فهو قابل للذوبان للغاية ويمكن أن يذوب في الماء ليشكل محلولًا واضحًا عديم اللون.
س: ما عدد جرامات كربونات البوتاسيوم اللازمة لتحضير 200 مل من محلول تركيزه 2.5 م؟
ج: لتحضير محلول 2.5 M K2CO3 في 200 مل من الماء، ستحتاج إلى إذابة 33.25 جرام من K2CO3 في الماء.
الحساب: المولارية = المولات / الحجم (باللتر) 2.5 م = المولات / 0.2 لتر المولات = 0.5 كتلة المول = المولات × الكتلة المولية = 0.5 مول × 138.21 جم / مول الكتلة = 33.25 جم
س: ما هو تركيز أيونات K في محلول 0.045 M K2CO3 بافتراض التفكك الكامل؟
ج: عندما يتفكك K2CO3 بالكامل في الماء، فإنه يشكل أيونين K+ وأيون CO32- واحد. ولذلك، فإن تركيز أيونات K+ في محلول 0.045 مولار K2CO3 سيكون ضعف مولارية محلول K2CO3، وهو 0.090 مولار.
