كبريتات الكالسيوم (CaSO4) عبارة عن مسحوق أبيض يوجد بشكل طبيعي أو يتم إنتاجه صناعيا. يتم استخدامه في البناء والغذاء والدواء بسبب خصائصه كمواد رابطة وحشو ومغذي.
| اسم الأيوباك | كبريتات الكالسيوم |
| الصيغة الجزيئية | CaSO4 |
| CAS رقم | 7778-18-9 |
| المرادفات | الجبس، الجبس اللامائي، الأنهيدريت، ثنائي الهيدرات، ملح الكالسيوم، السيلينيت |
| إنتشي | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
خصائص كبريتات الكالسيوم
صيغة كبريتات الكالسيوم
الصيغة الكيميائية لكبريتات الكالسيوم هي CaSO4. وهذا يعني أن كل جزيء من كبريتات الكالسيوم يحتوي على ذرة كالسيوم واحدة، وذرة كبريت واحدة، وأربع ذرات أكسجين. تُستخدم الصيغة لتمثيل تركيبة كبريتات الكالسيوم في المعادلات الكيميائية ولحساب كمية المواد المتفاعلة اللازمة في التفاعلات الكيميائية.
كبريتات الكالسيوم الكتلة المولية
تبلغ الكتلة المولية لـ CaSO4 حوالي 136.14 جم / مول. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لذرة كالسيوم واحدة وذرة كبريت واحدة وأربع ذرات أكسجين في المركب. تُستخدم الكتلة المولية لتحديد كمية CaSO4 اللازمة في التفاعلات الكيميائية وحساب تركيزها في المحاليل.
نقطة غليان كبريتات الكالسيوم
ليس لدى CaSO4 نقطة غليان محددة لأنه يخضع للتحلل الحراري قبل أن يصل إلى نقطة الغليان. ومع ذلك، يمكن تسخينه إلى درجات حرارة أعلى من 200 درجة مئوية دون التعرض للتحلل. عند درجات الحرارة المرتفعة، يخضع CaSO4 لتحلل ماص للحرارة ليشكل أكسيد الكالسيوم وثالث أكسيد الكبريت.
نقطة انصهار كبريتات الكالسيوم
تعتمد نقطة انصهار CaSO4 على حالة الماء الخاصة به. يحتوي الشكل اللامائي لـ CaSO4 على نقطة انصهار تبلغ حوالي 1460 درجة مئوية، في حين أن الشكل ثنائي الهيدرات له نقطة انصهار أقل تبلغ حوالي 128 درجة مئوية. تحتوي أشكال نصف الهيدرات وثلاثي الهيدرات على نقاط انصهار متوسطة.
كثافة كبريتات الكالسيوم جم/مل
تعتمد كثافة CaSO4 على شكله وحالته المائية. تبلغ كثافة الشكل اللامائي لـ CaSO4 حوالي 2.96 جم/مل، بينما تبلغ كثافة شكل ثنائي الهيدرات حوالي 2.32 جم/مل. الأشكال نصف المائية والثلاثية لها كثافات متوسطة.
الوزن الجزيئي لكبريتات الكالسيوم
يبلغ الوزن الجزيئي لـ CaSO4 حوالي 136.14 جم / مول. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لذرة كالسيوم واحدة وذرة كبريت واحدة وأربع ذرات أكسجين في المركب. يستخدم الوزن الجزيئي لحساب كمية CaSO4 اللازمة في التفاعلات الكيميائية وتحديد تركيزه في المحاليل.
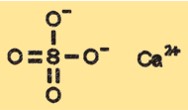
هيكل كبريتات الكالسيوم
يحتوي CaSO4 على بنية بلورية يمكن أن تختلف اعتمادًا على حالة الماء الخاصة به. يحتوي الشكل اللامائي لـ CaSO4 على بنية بلورية مُصنفة على أنها مُعينة لتقويم العظام، بينما يحتوي الشكل ثنائي الهيدرات على بنية بلورية أحادية الميل. تحتوي أشكال نصف الهيدرات وثلاثي الهيدرات على هياكل بلورية مختلفة تكون وسيطة بين الأشكال اللامائية وثنائي الهيدرات.
| مظهر | مسحوق أبيض أو صلب |
| جاذبية معينة | 2.96 (لا مائي)، 2.32 (ثنائي الهيدرات) |
| لون | أبيض أو عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 136.14 جرام/مول |
| كثافة | 2.96 جم/سم3 (لا مائي)، 2.32 جم/سم3 (ثنائي الهيدرات) |
| نقطة الانصهار | 1460 درجة مئوية (لا مائي)، 128 درجة مئوية (ثنائي الهيدرات) |
| نقطة الغليان | ليس لديه نقطة غليان محددة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 0.24 جم/100 مل (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء والجلسرين، غير قابل للذوبان في الإيثانول |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 9.8 (التفكك الأول)، 11.8 (التفكك الثاني) |
| الرقم الهيدروجيني | 7 (محايد) |
سلامة ومخاطر كبريتات الكالسيوم
يعتبر CaSO4 بشكل عام آمنًا للاستخدام والتعامل معه، ولكنه قد يشكل بعض المخاطر الصحية إذا لم يتم التعامل معه بشكل صحيح. يمكن أن يؤدي استنشاق غبار CaSO4 إلى تهيج الجهاز التنفسي، في حين أن تناول كميات كبيرة من المركب يمكن أن يسبب اضطرابًا في الجهاز الهضمي. قد يسبب ملامسة CaSO4 للعين والجلد تهيجًا أو جفافًا. يمكن أن يتفاعل CaSO4 أيضًا مع مواد كيميائية معينة لإنتاج منتجات ثانوية خطيرة. لذلك، يجب ارتداء معدات الحماية الشخصية المناسبة عند التعامل مع CaSO4 ويجب تخزينها في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | لا أحد |
| وصف الأمان | ضارة إذا ابتلعت. يسبب تهيج الجلد والعين. |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2833.29.00 |
| فئة الخطر | غير مصنف على أنه مادة أو خليط خطير وفقًا للائحة (EC) رقم 1272/2008 [CLP] |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران): أكبر من 2000 ملغم/كغم |
طرق تصنيع كبريتات الكالسيوم
تسمح عدة طرق بتصنيع CaSO4 اعتمادًا على الشكل المطلوب وحالة الماء للمركب.
الطريقة الشائعة هي تفاعل كربونات الكالسيوم أو أكسيد الكالسيوم مع حمض الكبريتيك. وينتج عن التفاعل CaSO4 وثاني أكسيد الكربون أو الماء، على التوالي.
تتضمن الطريقة الأخرى تفاعل كلوريد الكالسيوم مع كبريتات الصوديوم ، مما يؤدي إلى ترسيب CaSO4. يؤدي التجفيف الحراري للجبس، وهو شكل معدني طبيعي من ثنائي هيدرات CaSO4، إلى إنتاج CaSO4.
بعض العمليات الصناعية، مثل إزالة الكبريت من غاز المداخن في محطات توليد الطاقة، تنتج CaSO4 كمنتج ثانوي. خلال هذه العملية، يتفاعل ثاني أكسيد الكبريت مع كربونات الكالسيوم لتكوين كبريتيت الكالسيوم، الذي يخضع للأكسدة لإنتاج CaSO4.
يمكن أن تؤثر طريقة التركيب المستخدمة في CaSO4 على خصائصه، مثل حجم الجسيمات، والبلورة، والنقاء. لذلك من المهم اختيار الطريقة المناسبة للتطبيق المقصود للمركب.
استخدامات كبريتات الكالسيوم
يستخدم CaSO4 في العديد من الصناعات المختلفة نظرًا لخصائصه الفريدة بما في ذلك سميته المنخفضة ونقطة الانصهار العالية واللون الأبيض. تتضمن بعض الاستخدامات الشائعة لـ CaSO4 ما يلي:
- البناء: مكون رئيسي في الأسمنت والألواح الجصية، حيث يعمل كمواد رابطة ومعجون.
- الأغذية والمشروبات: يستخدم كمادة تخثر في إنتاج التوفو وكمادة مثبتة في بعض أنواع الجبن والخضروات المعلبة.
- المستحضرات الصيدلانية: يستخدم كمادة حشو وموثق في إنتاج الأقراص والكبسولات.
- الزراعة: يستخدم كمحسن للتربة لتحسين بنية التربة وزيادة إنتاجية المحاصيل.
- المواد الكيميائية: تستخدم في إنتاج المواد الكيميائية المختلفة، مثل الأصباغ والورق ومعالجة المنسوجات.
- مستحضرات التجميل: تستخدم في تركيبات مستحضرات التجميل كعامل منتفخ ومعتم.
- معالجة المياه: يستخدم في معالجة المياه لإزالة الشوائب وتقليل الحجم.
- البلاستيك والمطاط: يستخدم كمادة حشو وعامل تقوية في المنتجات البلاستيكية والمطاطية.
أسئلة:
س: هل كبريتات الكالسيوم نباتية؟
ج: نعم، يعتبر CaSO4 نباتيًا لأنه لا يأتي من مصادر حيوانية.
س: ما هو الاستخدام الرئيسي لكبريتات الكالسيوم في المستشفيات؟
ج: كان CaSO4 شائع الاستخدام في المستشفيات كجبيرة لكسور العظام.
س: ما هي كتل كبريتات الكالسيوم والفوسفور؟
ج: هذا السؤال غير كامل ويتطلب المزيد من المعلومات لتقديم إجابة محددة.
س: هل CaSO4 قابل للذوبان في الماء؟
ج: يتميز CaSO4 بقابلية منخفضة للذوبان في الماء، حيث تبلغ قابلية ذوبانه حوالي 2.05 جم/لتر في درجة حرارة الغرفة.
س: هل CaSO4 قابل للذوبان؟
ج: كبريتات الكالسيوم ذات قابلية منخفضة للذوبان في الماء، حيث تبلغ قابلية ذوبانها حوالي 2.05 جم / لتر في درجة حرارة الغرفة.
س: ما هي الكتلة المولية لـ CaSO4؟
ج: تبلغ الكتلة المولية لـ CaSO4 حوالي 136.14 جم/مول.
س: ما هو الملح الذي درجة حموضةه أقل من 7؟ Kbr، HCOOK، CaSO4، NH4NO3
ج: لا تحتوي أي من الأملاح المذكورة على درجة حموضة أقل من 7 في حالتها النقية. ومع ذلك، عندما يذوب في الماء، فإن NH4NO3 (نترات الأمونيوم) سينتج محلولًا حمضيًا بدرجة حموضة أقل من 7.
