كبريتيت الكالسيوم (CaSO3) هو مركب يحتوي على أيونات Ca2+ وSO32-. غالبًا ما يستخدم كمادة حافظة للأغذية ومضاد للأكسدة ومنقي للمياه نظرًا لقدرته على إزالة الشوائب ومنع التلف.
| اسم الأيوباك | كبريتات الكالسيوم |
| الصيغة الجزيئية | CaSO3 |
| CAS رقم | 10257-55-3 |
| المرادفات | كبريتيت الكالسيوم. حامض الكبريتيك، ملح الكالسيوم. حامض الكبريتيك الكالسيوم. حامض الكبريتيك الكالسيوم. E226 |
| إنتشي | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
خصائص كبريتيت الكالسيوم
صيغة كبريتات الكالسيوم
الصيغة الكيميائية لكبريتات الكالسيوم هي CaSO3. يتكون هذا المركب من أيون Ca2+ وأيون SO32-. يمكن تحضير كبريتيت الكالسيوم عن طريق تفاعل هيدروكسيد الكالسيوم مع حمض الكبريتيك. ويشيع استخدامه في صناعة المواد الغذائية كمادة حافظة ومضادة للأكسدة، فضلا عن تنقية المياه.
كبريتات الكالسيوم الكتلة المولية
الكتلة المولية لـ CaSO3 هي 120.14 جم / مول. ويمكن حساب ذلك عن طريق إضافة الكتل الذرية للكالسيوم (40.08 جم/مول)، والكبريت (32.06 جم/مول)، وثلاث ذرات أكسجين (16.00 جم/مول لكل منهما).
نقطة غليان كبريتات الكالسيوم
ليس لدى CaSO3 نقطة غليان محددة جيدًا لأنه يتحلل قبل الوصول إلى نقطة الغليان. ومع ذلك، يمكن تسخينه إلى درجة حرارة حوالي 450 درجة مئوية قبل حدوث التحلل. وذلك لأن CaSO3 مركب غير مستقر ويميل إلى التحلل إلى كبريتات الكالسيوم وثاني أكسيد الكبريت عند تسخينه.
نقطة انصهار كبريتات الكالسيوم
تبلغ نقطة انصهار CaSO3 حوالي 1520 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة. يحتوي CaSO3 على بنية بلورية ويذوب عند درجات حرارة عالية بسبب الروابط الأيونية القوية بين أيونات الكالسيوم والكبريتيت.
كثافة كبريتيت الكالسيوم جم/مل
تبلغ كثافة CaSO3 حوالي 2.71 جم / مل. وهذا يعني أن الملليلتر الواحد من CaSO3 له كتلة 2.71 جرام. تعود الكثافة العالية لـ CaSO3 إلى وجود أيون الكالسيوم الذي يتمتع بكتلة ذرية عالية.
الوزن الجزيئي لكبريتات الكالسيوم
الوزن الجزيئي لـ CaSO3 هو 120.14 جم / مول. ويمكن حساب ذلك عن طريق إضافة الأوزان الذرية للكالسيوم والكبريت وثلاث ذرات أكسجين في المركب. الوزن الجزيئي لـ CaSO3 مهم في تحديد خواصه الفيزيائية والكيميائية.
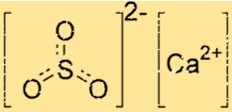
هيكل كبريتيت الكالسيوم
يتكون هيكل CaSO3 من أيون Ca2+ واحد وأيون SO32-. ويحاط أيون الكالسيوم بست ذرات أكسجين، بينما يحتوي أيون الكبريتيت على ذرتي أكسجين وذرة كبريت واحدة. يتم ربط أيون Ca2+ وأيون SO32- معًا بواسطة روابط أيونية، وهي قوى جذب كهروستاتيكية قوية بين الأيونات المشحونة بشكل متعاكس.
ذوبان كبريتيت الكالسيوم
CaSO3 قليل الذوبان في الماء، مع قابلية ذوبان تبلغ حوالي 0.17 جم / 100 مل في درجة حرارة الغرفة. وهذا يعني أن كمية صغيرة فقط من CaSO3 يمكن أن تذوب في الماء وستظل الجزيئات الصلبة المتبقية معلقة في الماء. تتأثر قابلية ذوبان CaSO3 بعوامل مثل درجة الحرارة ودرجة الحموضة ووجود أيونات أخرى.
| مظهر | مسحوق أبيض أو مادة صلبة بلورية |
| جاذبية معينة | 2.71 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 120.14 جرام/مول |
| كثافة | 2.71 جم/مل |
| نقطة الانصهار | 1520 درجة مئوية |
| نقطة الغليان | يتحلل قبل الوصول إلى درجة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان قليلا، تقريبا. 0.17 جم/100 مل في درجة حرارة الغرفة. |
| الذوبان | غير قابلة للذوبان في الكحول والأثير |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 1.91 |
| الرقم الهيدروجيني | أساسي قليلاً (الرقم الهيدروجيني 8-9 عند إذابته في الماء) |
السلامة ومخاطر كبريتيت الكالسيوم
يعتبر CaSO3 بشكل عام آمنًا للاستخدام في تطبيقات معالجة الأغذية والمياه. ومع ذلك، مثل أي مادة كيميائية، يمكن أن تشكل مخاطر معينة إذا لم يتم التعامل معها بشكل صحيح. يعتبر CaSO3 مهيجًا للجلد والعين وقد يسبب تهيجًا في الجهاز التنفسي في حالة استنشاقه. تناول كميات كبيرة من CaSO3 يمكن أن يسبب الغثيان والقيء والإسهال. عند التعامل مع CaSO3، ينبغي اتخاذ احتياطات السلامة المناسبة، مثل ارتداء القفازات والنظارات الواقية. يجب على المرء أن يطلب العناية الطبية على الفور إذا لامس CaSO3 على الجلد أو العينين أو إذا تناوله. ومن المهم أيضًا اتباع إجراءات تخزين CaSO3 المناسبة والتخلص منها لتقليل المخاطر المحتملة.
| رموز الخطر | لم يتم تعيين أي شيء |
| وصف الأمان | تجنب ملامسة العينين والجلد، والملابس. ارتداء القفازات والنظارات الواقية عند التعامل. في حالة ملامسته، اشطفي المناطق المصابة بالماء. في حالة ابتلاعه، اطلب العناية الطبية على الفور. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 283210 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | يعتبر كبريتيت الكالسيوم غير سام عند تناوله بتركيزات منخفضة، ولكنه قد يسبب تهيج الجهاز الهضمي وآثارًا صحية أخرى عند تناول جرعات عالية. |
طرق تصنيع كبريتيت الكالسيوم
يمكن لتفاعل حمض الكبريتيك مع هيدروكسيد الكالسيوم تصنيع CaSO3. ينتج عن التفاعل CaSO3 والماء كمنتجات ثانوية.
تتضمن الطريقة الأخرى تفاعل كربونات الكالسيوم مع حمض الكبريت، مما ينتج عنه CaSO3 والماء وثاني أكسيد الكربون. عادة، يقوم الكيميائيون بإجراء التفاعل في محلول مائي في درجة حرارة الغرفة أو أعلى قليلاً.
وفي طريقة أخرى، ينتج عن تفاعل أكسيد الكالسيوم مع ثاني أكسيد الكبريت ثم إضافة الماء إلى المنتج الناتج CaSO3.
في البيئات الصناعية، يؤدي امتصاص ثاني أكسيد الكبريت في محلول هيدروكسيد الكالسيوم إلى إنتاج CaSO3 بشكل عام. تنتج هذه العملية خليطًا من CaSO3 وكبريتات الكالسيوم، والذي يمكن فصله بالترشيح أو بطرق أخرى. ويمكن استخدام CaSO3 الناتج في مجموعة متنوعة من التطبيقات، بما في ذلك معالجة المياه وكمادة حافظة للأغذية.
بشكل عام، هناك عدة طرق لتصنيع CaSO3، ولكل منها مزاياها وقيودها الخاصة اعتمادًا على التطبيق المحدد والنقاء المطلوب للمنتج النهائي.
استخدامات كبريتات الكالسيوم
CaSO3 له استخدامات مختلفة في صناعات مختلفة بسبب خصائصه الفريدة. تتضمن بعض الاستخدامات الشائعة لـ CaSO3 ما يلي:
- معالجة المياه: غالبًا ما يستخدم كعامل لمعالجة المياه لإزالة الشوائب وتطهير المياه. يمكنه إزالة الكلور والمعادن الثقيلة والملوثات الأخرى من الماء بشكل فعال.
- حفظ الأغذية: يستخدم كمادة حافظة للأغذية لمنع تلفها ولإطالة مدة صلاحية المنتجات الغذائية. يشيع استخدامها في إنتاج الأطعمة المعلبة والمعبأة في زجاجات، وكذلك في صناعة النبيذ والبيرة.
- الصناعة الكيميائية: يستخدم في الصناعة الكيميائية كعامل اختزال وفي إنتاج حامض الكبريتيك.
- البناء: يستخدم كمكون من مواد البناء مثل الحوائط الجافة والأسمنت.
- الصناعة الزراعية: يستخدم في الزراعة لعلاج التربة والوقاية من أمراض النبات.
- التطبيقات الطبية: يستخدم أيضًا في التطبيقات الطبية كمضاد للأكسدة وكعلاج لبعض الحالات الطبية.
أسئلة:
س: ما هي صيغة كبريتات الكالسيوم؟
ج: صيغة كبريتيت الكالسيوم هي CaSO3.
س: ما هي حالة كبريتات الكالسيوم؟
ج: CaSO3 مادة صلبة في درجة حرارة الغرفة.
س: كم جرامًا من الكالسيوم يوجد في 3.36 جرام من CaSO3؟
ج: يوجد ما يقرب من 1.14 جرامًا من الكالسيوم في 3.36 جرامًا من CaSO3.
س: ماذا يحدث عند إضافة كربونات الكالسيوم إلى حمض الهيدروكلوريك وكبريتيت الصوديوم؟
ج: عند إضافة كربونات الكالسيوم إلى حمض الهيدروكلوريك وكبريتيت الصوديوم، يحدث تفاعل ينتج CaSO3 والماء وثاني أكسيد الكربون وكلوريد الصوديوم.
س: هل يذوب كبريتيت الكالسيوم في الماء؟
ج: نعم، CaSO3 قليل الذوبان في الماء.
س: هل يوجد كبريتات الكالسيوم في مياه المدينة؟
ج: لا يوجد CaSO3 بشكل شائع في مياه المدينة، ولكن يمكن استخدامه في عمليات معالجة المياه لإزالة الشوائب.
س: هل يمكن إزالة CaSO3 من مياه الشرب؟
ج: نعم، يمكن إزالة CaSO3 من مياه الشرب بطرق مختلفة مثل الترشيح أو التناضح العكسي أو المعالجة الكيميائية.
س: ماذا ينتج CaSO3 وHCl؟
ج: عند إضافة CaSO3 إلى حمض الهيدروكلوريك، يحدث تفاعل ينتج كلوريد الكالسيوم، وغاز ثاني أكسيد الكبريت، والماء.
