فلوريد النيكل (NiF2) مركب كيميائي. وتتكون من ذرات النيكل والفلور. يستخدم في تطبيقات مختلفة بما في ذلك البطاريات والطلاء الكهربائي بسبب خصائصه الفريدة.
| اسم الأيوباك | فلوريد النيكل (II). |
| الصيغة الجزيئية | NiF2 |
| CAS رقم | 10028-18-9 |
| المرادفات | ثنائي فلوريد النيكل، فلوريد النيكل، ثنائي فلورونيكل |
| إنتشي | InChI=1S/2FH.Ni/h2*1H;/q;;+2/p-2 |
خصائص فلوريد النيكل
صيغة فلوريد النيكل
الصيغة الكيميائية لثنائي فلوريد النيكل هي NiF2. وهذا يعني أن كل جزيء ثنائي فلوريد النيكل يتكون من ذرة نيكل واحدة وذرتين فلور مرتبطتين معًا.
فلوريد النيكل الكتلة المولية
يحتوي ثنائي فلوريد النيكل على كتلة مولية تبلغ حوالي 96.69 جرامًا لكل مول. يتم حساب هذه القيمة عن طريق إضافة الكتل الذرية لذرة نيكل واحدة (58.69 جم / مول) وذرتين من الفلور (18.998 جم / مول لكل منهما).
نقطة غليان فلوريد النيكل
نقطة غليان ثنائي فلوريد النيكل مرتفعة نسبيًا، حوالي 1568 درجة مئوية (2854 درجة فهرنهايت). تمثل درجة الحرارة هذه النقطة التي يتغير عندها ثنائي فلوريد النيكل من الحالة السائلة إلى الحالة الغازية.
نقطة انصهار فلوريد النيكل
يمتلك ثنائي فلوريد النيكل نقطة انصهار تبلغ حوالي 1372 درجة مئوية (2502 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها ثنائي فلوريد النيكل الصلب إلى سائل.
كثافة فلوريد النيكل جم/مل
تبلغ كثافة ثنائي فلوريد النيكل حوالي 4.72 جرام لكل سنتيمتر مكعب (جم / سم مكعب). تعطي قيمة الكثافة هذه نظرة عامة على كثافة الجزيئات في حجم معين من المادة.
الوزن الجزيئي لفلوريد النيكل
يبلغ الوزن الجزيئي لثنائي فلوريد النيكل حوالي 96.69 جرامًا لكل مول. ويتم تحديده عن طريق إضافة الأوزان الذرية للعناصر المكونة له في الصيغة الكيميائية NiF2.
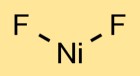
هيكل فلوريد النيكل
يحتوي ثنائي فلوريد النيكل على هيكل بلوري. توجد ذرة النيكل في المنتصف، مرتبطة بذرتين من الفلور. يؤدي ترتيب الذرات إلى ظهور نمط متكرر، مما يشكل شبكة بلورية.
ذوبان فلوريد النيكل
ثنائي فلوريد النيكل ضعيف الذوبان في الماء. تتأثر قابليته للذوبان بعوامل مثل درجة الحرارة ووجود مواد أخرى. عندما يذوب، فإنه يتفكك إلى أيونات Ni+2 وF- في المحلول المائي.
| مظهر | الصلبة البلورية الخضراء |
| جاذبية معينة | 4.72 جم/سم3 |
| لون | أخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | 96.69 جرام/مول |
| كثافة | 4.72 جم/سم3 |
| نقطة الانصهار | 1372 درجة مئوية (2502 درجة فهرنهايت) |
| نقطة الغليان | 1,568 درجة مئوية (2,854 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ضعيف الذوبان |
| الذوبان | يذوب في الماء، وينفصل إلى أيونات النيكل وأيونات الفلورايد |
| ضغط البخار | غير محددة بشكل جيد |
| كثافة بخار | غير محددة بشكل جيد |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر فلوريد النيكل
يشكل ثنائي فلوريد النيكل مخاطر محتملة على السلامة. قد يسبب تهيج الجلد والعين عند ملامسته. استنشاق غبارها أو أبخرتها قد يسبب تهيج الجهاز التنفسي. التعرض لفترات طويلة يمكن أن يؤدي إلى آثار صحية أكثر خطورة. وينبغي استخدام تدابير الحماية المناسبة، بما في ذلك القفازات ونظارات السلامة، عند التعامل مع ثنائي فلوريد النيكل. يجب أن تكون أماكن العمل جيدة التهوية لتقليل خطر الاستنشاق. في حالة الابتلاع أو الاتصال العرضي، من الضروري الحصول على رعاية طبية. ويجب أيضًا أخذ التأثير البيئي المحتمل لثنائي فلوريد النيكل في الاعتبار، ويجب أن يتبع التخلص منه اللوائح المناسبة لتجنب التلوث.
| رموز الخطر | المخاطر الصحية |
| وصف الأمان | يسبب تهيج الجلد والعين. ضار إذا تم استنشاقه أو ابتلاعه. التعرض لفترات طويلة قد يسبب آثارا صحية أكثر خطورة. التعامل مع معدات الحماية المناسبة. تجنب الاستنشاق والاتصال. |
| أرقام تعريف الأمم المتحدة | لا ينسب |
| رمز النظام المنسق | 2826.20.1000 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | ثالثا |
| تسمم | سامة إلى حد ما |
طرق تصنيع فلوريد النيكل
يمكن تصنيع ثنائي فلوريد النيكل بطرق مختلفة. يتضمن النهج الشائع التفاعل بين أكسيد النيكل (NiO) أو كربونات النيكل (NiCO3) مع حمض الهيدروفلوريك (HF):
- التفاعل مع حمض الهيدروفلوريك :
- طريقة أكسيد النيكل (NiO): NiO + 2 HF → NiF2 + H2O
- كربونات النيكل (NiCO3) الطريقة: NiCO3 + 4 HF → NiF2 + CO2 + 2 H2O
هناك طريقة أخرى تستخدم التفاعل بين كلوريد النيكل (NiCl2) وفلوريد الأمونيوم (NH4F):
- التفاعل مع فلوريد الأمونيوم : NiCl2 + 2 NH4F → NiF2 + 2 NH4Cl
بالإضافة إلى ذلك، يمكن الحصول على ثنائي فلوريد النيكل من تفاعل أكسيد النيكل مع فلوريد الأمونيوم:
- التفاعل مع فلوريد الأمونيوم (طريقة أكسيد النيكل) : NiO + 2 NH4F → NiF2 + 2 H2O + (NH4)2O
تتم هذه الطرق عمومًا في درجات حرارة وظروف يتم التحكم فيها لضمان التوليف المناسب ونقاء المنتج. ومن الضروري التعامل مع حمض الهيدروفلوريك والكواشف الأخرى بحذر بسبب مخاطرها المحتملة. يمكن تنقية ثنائي فلوريد النيكل الناتج ومعالجته لتطبيقات مختلفة، مثل مواد البطاريات والطلاء الكهربائي.
استخدامات فلوريد النيكل
يجد ثنائي فلوريد النيكل (NiF2) العديد من التطبيقات نظرًا لخصائصه الفريدة. إنه يخدم في مختلف الصناعات لأغراض متميزة:
- تكنولوجيا البطاريات: تستخدم كمكون في بطاريات الليثيوم أيون مما يحسن من أدائها واستقرارها.
- الطلاء الكهربائي: يستخدم في عمليات الطلاء الكهربائي لإنشاء طلاءات نيكل متينة ومقاومة للتآكل على مواد مختلفة.
- التحفيز: يعمل كمحفز في بعض التفاعلات الكيميائية، ويساعد في تركيب المنتجات القيمة.
- الزجاج والسيراميك: يدخل في إنتاج الزجاج والسيراميك الخاص، مما يعمل على تحسين خواصهما وخصائصهما.
- الفلورة: تستخدم لفلورة المياه لتحسين صحة الأسنان عن طريق منع تسوس الأسنان.
- التصنيع الكيميائي: يعمل كمقدمة في تصنيع مركبات النيكل والمواد الكيميائية الأخرى.
- المكثفات الخزفية: تدخل في صناعة المكثفات الخزفية المستخدمة في الإلكترونيات والاتصالات.
- المستحضرات الصيدلانية: تستخدم كواشف في بعض العمليات والأبحاث الصيدلانية.
- التصوير الفوتوغرافي: تم استخدامه تاريخياً في صناعة التصوير الفوتوغرافي كأحد مكونات بعض مطوري التصوير الفوتوغرافي.
- مادة مضافة للسبائك المعدنية: تضاف إلى بعض السبائك المعدنية لتحسين خصائصها مثل القوة والمتانة.
إن الخصائص القابلة للتكيف لثنائي فلوريد النيكل تجعله مورداً قيماً عبر مجموعة واسعة من الصناعات، مما يساهم في التقدم في التكنولوجيا والرعاية الصحية والتصنيع.
أسئلة:
س: ما المنتجات الموجودة عند القطبين أثناء التحليل الكهربي لمحلول NiF2(aq)؟
ج: عند الكاثود يتكون معدن النيكل (Ni)، بينما عند الأنود يتطور غاز الفلور (F2).
س: ماذا ينتج التحليل الكهربائي NiF2؟
ج: يتم إنتاج النيكل المعدني عند الكاثود ويتطور غاز الفلور عند الأنود أثناء التحليل الكهربي لـ NiF2.
س: المركب NiF2 مركب أيوني. ما هي الأيونات التي تشكلها؟
ج: يتكون NiF2 من أيونات النيكل (Ni²⁺) وأيونات F-.
س: ما نوع التفاعل الذي يتكون من Ni(s) + F2 —> NiF2(s)؟
ج: التفاعل Ni(s) + F2 → NiF2(s) هو تفاعل مركب (توليفي).
س: ما اسم المركب الذي صيغته NiF2؟
ج: المركب الذي له الصيغة NiF2 يسمى ثنائي فلوريد النيكل (II).
س: أين يستخدم فلوريد النيكل (II)؟
ج: يُستخدم ثنائي فلوريد النيكل (II) في تكنولوجيا البطاريات، والطلاء الكهربائي، والمحفزات، وصناعة السيراميك.
س: ما هي صيغة فلوريد النيكل (II)؟
ج: صيغة ثاني فلوريد النيكل (II) هي NiF2.
س: هل يترسب فلوريد النيكل (II) وهيدروكسيد الصوديوم؟
ج: نعم، تترسب على شكل مادة صلبة خضراء اللون هي هيدروكسيد النيكل (II).
س: هل فلوريد النيكل موصل للكهرباء؟
ج: نعم، يمكن لثنائي فلوريد النيكل توصيل الكهرباء في الحالة المنصهرة أو عند ذوبانه في الماء.
س: هل فلوريد النيكل المنصهر أم الجرافيت أكثر موصلية؟
ج: يعتبر ثنائي فلوريد النيكل المنصهر أكثر موصلية للكهرباء من الجرافيت بسبب طبيعته الأيونية وأيوناته المتحركة.
