خلات الصوديوم (C2H3NaO2) هو مركب يتكون من أيونات Na+ وC2H3O2-. ويشيع استخدامه كمضافات غذائية وفي التطبيقات الطبية، كما هو الحال في محاليل غسيل الكلى، وكمصدر للكربون لبعض البكتيريا.
| اسم الأيوباك | أسيتات الصوديوم |
| الصيغة الجزيئية | C2H3NaO2 |
| CAS رقم | 127-09-3 |
| المرادفات | ملح الصوديوم من حمض الخليك، إيثانوات الصوديوم، ناتريوم أسيتات |
| إنتشي | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
خصائص خلات الصوديوم
صيغة خلات الصوديوم
الصيغة الكيميائية لخلات الصوديوم هي NaC2H3O2. يشير هذا إلى أن المركب يتكون من أيون Na+ واحد وأيون C2H3O2- واحد. يتكون أيون C2H3O2 من ذرة كربون واحدة وذرتين أكسجين وثلاث ذرات هيدروجين. الصيغة مفيدة لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية والتنبؤ بسلوك المركب في ظل ظروف مختلفة.
خلات الصوديوم الكتلة المولية
NaC2H3O2 لديه كتلة مولية تبلغ 82.03 جم / مول. وهذا يعني أن المول الواحد من NaC2H3O2 يزن 82.03 جرامًا. يتم حساب الكتلة المولية عن طريق إضافة الكتل الذرية لكل عنصر في المركب. تبلغ كتلة الصوديوم 22.99 جم / مول، وكتلة الكربون 12.01 جم / مول، وكتلة الهيدروجين 1.01 جم / مول، وكتلة الأكسجين 16.00 جم / مول. تعتبر الكتلة المولية لـ NaC2H3O2 مفيدة في تحديد كمية المركب الموجود في عينة معينة.
نقطة غليان خلات الصوديوم
NaC2H3O2 لديه نقطة غليان تبلغ 881 درجة مئوية (1618 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من سائل إلى غاز. ترجع نقطة الغليان العالية لـ NaC2H3O2 إلى الروابط الأيونية القوية بين أيونات الصوديوم والأسيتات. عند درجات الحرارة المرتفعة، تنكسر هذه الروابط ويتبخر المركب.
خلات الصوديوم نقطة الانصهار
NaC2H3O2 لديه نقطة انصهار تبلغ 324 درجة مئوية (615 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة من الحالة الصلبة إلى الحالة السائلة. ترجع نقطة الانصهار العالية لـ NaC2H3O2 أيضًا إلى الروابط الأيونية القوية بين أيونات الصوديوم والأسيتات. عند درجات الحرارة المرتفعة، تضعف هذه الروابط ويذوب المركب.
كثافة خلات الصوديوم جم/مل
تبلغ كثافة NaC2H3O2 1.45 جم / مل. الكثافة هي مقدار الكتلة لكل وحدة حجم من المادة. ترجع الكثافة العالية لـ NaC2H3O2 إلى الترتيب المدمج لجزيئاته. يمكن أن تختلف كثافة NaC2H3O2 اعتمادًا على تركيزها في المحلول.
خلات الصوديوم الوزن الجزيئي
الوزن الجزيئي لـ NaC2H3O2 هو 82.03 جم / مول. وهي كتلة مول واحد من المركب. الوزن الجزيئي مفيد لتحديد كمية المركب في عينة معينة، وكذلك لحساب قياس العناصر الكيميائية للتفاعلات الكيميائية.
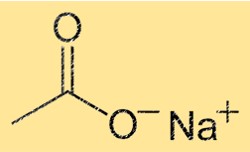
هيكل خلات الصوديوم
يحتوي NaC2H3O2 على بنية بلورية مع وحدة متكررة Na(CH3COO). وهذا يعني أن كل وحدة خلية من البلورة تحتوي على أيون صوديوم واحد وأيون أسيتات واحد. ويحاط أيون Na+ بست ذرات أكسجين، بينما يتكون أيون C2H3O2- من ذرة كربون واحدة وذرتي أكسجين وثلاث ذرات هيدروجين. الروابط الأيونية القوية بين الأيونات تمنح البلورة ثباتها ونقاط انصهارها وغليانها العالية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.45 عند 20 درجة مئوية |
| لون | عديم اللون أو أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 82.03 جرام/مول |
| كثافة | 1.45 جم/سم3 عند 20 درجة مئوية |
| نقطة الانصهار | 324 درجة مئوية (615 درجة فهرنهايت) |
| نقطة الغليان | 881 درجة مئوية (1618 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 820 جم/لتر (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء، الإيثانول، الأسيتون |
| ضغط البخار | 1 ملم زئبق عند 239.2 درجة مئوية |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 4.76 (عند 25 درجة مئوية) |
| الرقم الهيدروجيني | 7 (محلول 1%) |
السلامة ومخاطر خلات الصوديوم
يعتبر NaC2H3O2 آمنًا بشكل عام للتعامل والاستخدام عند اتخاذ الاحتياطات المناسبة. ومع ذلك، فإنه قد يسبب تهيج الجلد والعين، كما أن تناول أو استنشاق كميات كبيرة منه قد يسبب تهيج الجهاز الهضمي، ومشاكل في الجهاز التنفسي، واكتئاب الجهاز العصبي المركزي. يمكن أن يتفاعل NaC2H3O2 أيضًا مع العوامل المؤكسدة القوية والأحماض والقلويات، مما يؤدي إلى توليد الحرارة والغازات الخطرة. ومن المهم ارتداء معدات الحماية الشخصية المناسبة عند التعامل مع NaC2H3O2، بما في ذلك القفازات وحماية العين. يجب تخزين NaC2H3O2 في مكان بارد وجاف وجيد التهوية بعيدًا عن المواد غير المتوافقة. في حالة التعرض العرضي أو الابتلاع، اطلب العناية الطبية على الفور.
| رموز الخطر | لا أحد |
| وصف الأمان | تجنب ملامسة الجلد والعينين. لا استوعب أو يستنشق. استخدام في مناطق جيدة التهوية. |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2915.21.00 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة |
طرق تصنيع خلات الصوديوم
هناك عدة طرق لتصنيع NaC2H3O2، لكن الطريقة الأكثر شيوعًا تتضمن تفاعل تحييد حمض الأسيتيك وهيدروكسيد الصوديوم . معادلة التفاعل هي كما يلي:
CH3COOH + هيدروكسيد الصوديوم → CH3COONa + H2O
لإجراء التفاعل، يتم تحضير محلول حمض الأسيتيك أولاً عن طريق إذابة حمض الأسيتيك الجليدي في الماء. أثناء التحريك، أضف هيدروكسيد الصوديوم ببطء إلى محلول حمض الأسيتيك حتى يصل الرقم الهيدروجيني للمحلول إلى 7 تقريبًا.
عند هذه النقطة سيحتوي المحلول على NaC2H3O2 والماء. للحصول على NaC2H3O2 الصلب، يمكن تبخير المحلول على نار خفيفة حتى يجف. وبدلاً من ذلك، يمكن ترك المحلول ليبرد إلى درجة حرارة الغرفة وسوف تترسب بلورات NaC2H3O2 من تلقاء نفسها.
هناك طريقة أخرى لتصنيع NaC2H3O2 تتضمن التفاعل بين أنهيدريد الخل وكربونات الصوديوم . معادلة التفاعل هي كما يلي:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
ينتج عن هذا التفاعل NaC2H3O2 وثاني أكسيد الكربون وأول أكسيد الكربون والماء.
تبخر خليط التفاعل حتى الجفاف ثم تبلوره في الماء يمكن أن يعطي NaC2H3O2 في الحالة الصلبة. التكلفة العالية لأنهيدريد الخل تجعل هذه الطريقة قليلة الاستخدام.
استخدامات خلات الصوديوم
NaC2H3O2 هي مادة كيميائية متعددة الاستخدامات ولها العديد من التطبيقات الصناعية والعلمية. فيما يلي بعض استخداماته الشائعة:
- عامل التخزين المؤقت: يشيع استخدامه كعامل تخزين مؤقت في التطبيقات الكيميائية والبيولوجية. يساعد في الحفاظ على درجة حموضة ثابتة ومنع تقلبات الحموضة.
- عبوات التدفئة: تستخدم في إنتاج عبوات التدفئة أو منصات التدفئة. هذه الأكياس صغيرة الحجم ويمكن تسخينها لتوفير الحرارة لمنطقة معينة من الجسم.
- المضافات الغذائية: تستخدم كمضافات غذائية، بشكل رئيسي كمحسن للنكهة، ومنظم لدرجة الحموضة والمواد الحافظة. عادة ما يقوم مصنعو الأغذية المصنعة بإدراجه في الوجبات الخفيفة والصلصات ومنتجات اللحوم.
- صناعة النسيج: يستخدم في صناعة النسيج كمساعد للصباغة والطباعة. يساعد على تحسين امتصاص الصبغة وثبات لون الأقمشة.
- التركيب الكيميائي: يستخدم ككاشف في التفاعلات الكيميائية المختلفة. يحول الكحولات إلى هاليدات الألكيل المقابلة وينتج أنهيدريد الخل من حمض الأسيتيك.
- التطبيقات الطبية: يستخدم في التطبيقات الطبية مثل غسيل الكلى وكأحد مكونات محاليل الإلكتروليت.
- التصوير الفوتوغرافي: يستخدم في التصوير الفوتوغرافي كمحلول تثبيتي لإزالة هاليدات الفضة غير المكشوفة من المطبوعات الفوتوغرافية والصور السلبية.
أسئلة:
س: ما هو الغرض من خلات الصوديوم في تخليق الأميد؟
ج: يستخدم NaC2H3O2 في تخليق الأميد كقاعدة لنزع بروتونات المجموعة الأمينية من المادة الأولية. وهذا يسهل التفاعل مع الحمض الكربوكسيلي لتكوين رابطة الأميد.
س: ما هو الغرض من محلول خلات الصوديوم في تخليق الأميد؟
ج: يستخدم محلول NaC2H3O2 كمحفز أساسي في تخليق الأميد. فهو يساعد على نزع بروتونات المجموعة الأمينية من المادة الأولية، مما يجعلها أكثر تفاعلاً تجاه الحمض الكربوكسيلي.
س: هل أساس خلات الصوديوم؟
ج: نعم، NaC2H3O2 قاعدة. وهو القاعدة المرافقة لحمض الأسيتيك ويبلغ الرقم الهيدروجيني له حوالي 9 عند إذابته في الماء.
س: ما هو خلات الصوديوم؟
ج: NaC2H3O2 هو ملح صوديوم لحمض الأسيتيك، صيغته الكيميائية NaCH3COO. وهو مسحوق أبيض عديم الرائحة بلوري، قابل للذوبان في الماء.
س: ما هو الغرض من محلول خلات الصوديوم في تخليق أميد الأسيتوفينيتيدين؟
ج: في تخليق أميد الأسيتوفينيتيدين، يتم استخدام محلول NaC2H3O2 كمحفز أساسي لتسهيل التفاعل بين p-فينيتيدين وأنهيدريد الأسيتيك. فهو يساعد على نزع بروتونات المجموعة الأمينية من الفينيتيدين وتنشيطها تجاه هجوم محب للنواة بواسطة أنهيدريد الخل. وهذا يؤدي إلى تشكيل الأسيتوفينيتيدين.
