خلات الأمونيوم هو مركب يستخدم في مختلف الصناعات. وهو يعمل كمصدر لأيونات الخلات ويلعب دورًا في التفاعلات الكيميائية والتخليق العضوي.
| اسم الأيوباك | امونيوم اسيتات |
| الصيغة الجزيئية | C2H7NO2 |
| CAS رقم | 631-61-8 |
| المرادفات | ملح الأمونيوم من حمض الأسيتيك، إيثانوات الأمونيوم، حمض الأسيتيك الأمونيوم، حمض الأسيتيك، ملح الأمونيوم |
| إنتشي | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
خصائص خلات الأمونيوم
صيغة خلات الأمونيوم
صيغة ملح الأمونيوم لحمض الأسيتيك هي C2H7NO2. ويتكون من ذرتين كربون، وسبع ذرات هيدروجين، وذرة نيتروجين واحدة، وذرتين أكسجين.
خلات الأمونيوم الكتلة المولية
يتم حساب الكتلة المولية لملح الأمونيوم لحمض الأسيتيك عن طريق إضافة الكتل الذرية للعناصر المكونة له. هذا ما يقرب من 77.0825 جرامًا لكل مول.
نقطة غليان خلات الأمونيوم
تبلغ درجة غليان ملح الأمونيوم الخاص بحمض الأسيتيك حوالي 117 درجة مئوية. عند درجة الحرارة هذه، يخضع المركب لتغير طوري من السائل إلى الغاز.
خلات الأمونيوم نقطة الانصهار
تبلغ نقطة انصهار ملح الأمونيوم لحمض الأسيتيك حوالي 114 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة.
كثافة خلات الأمونيوم جم/مل
تبلغ كثافة ملح الأمونيوم لحمض الأسيتيك حوالي 1.17 جرام لكل مليلتر. وهو مقياس للكتلة لكل وحدة حجم من المركب.
خلات الأمونيوم الوزن الجزيئي
يبلغ الوزن الجزيئي لملح الأمونيوم لحمض الأسيتيك حوالي 77.0825 جرامًا لكل مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب.
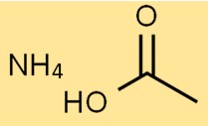
هيكل خلات الأمونيوم
يتكون هيكل ملح الأمونيوم لحمض الأسيتيك من أيون NH4+ واحد وأيون CH3COO- واحد. يكون أيون NH4+ مشحونًا بشكل إيجابي، بينما يكون أيون CH3COO- سالبًا.
ذوبان خلات الأمونيوم
ملح الأمونيوم لحمض الأسيتيك قابل للذوبان بدرجة عالية في الماء. يذوب بسهولة في الماء ليشكل محلول شفاف عديم اللون. ترجع قابلية ذوبان ملح الأمونيوم لحمض الأسيتيك في الماء إلى قدرته على تكوين روابط هيدروجينية مع جزيئات الماء.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.17 جرام/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 77.0825 جرام/مول |
| كثافة | 1.17 جرام/مل |
| نقطة الانصهار | 114 درجة مئوية |
| نقطة الغليان | 117 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الماء، وحمض الخليك، والإيثانول |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | 4.75 |
| الرقم الهيدروجيني | حوالي 6.0-7.0 |
السلامة ومخاطر خلات الأمونيوم
يشكل ملح الأمونيوم الموجود في حمض الأسيتيك الحد الأدنى من مخاطر السلامة عند التعامل معه بشكل صحيح. يعتبر استخدامه آمنًا بشكل عام في التطبيقات المختلفة. ومع ذلك، كما هو الحال مع أي مادة كيميائية، يجب اتخاذ الاحتياطات اللازمة. تجنب استنشاق الأتربة أو الأبخرة، لأن ذلك قد يسبب تهيج الجهاز التنفسي. ومن المستحسن ارتداء معدات الحماية الشخصية المناسبة، بما في ذلك القفازات ونظارات السلامة، عند العمل مع ملح الأمونيوم وحمض الخليك. في حالة الابتلاع العرضي أو ملامسة العينين أو الجلد، اشطفه بالكثير من الماء واستشر الطبيب إذا لزم الأمر. يخزن ملح الأمونيوم من حمض الأسيتيك في مكان بارد وجاف بعيدا عن المواد غير المتوافقة. اتبع إجراءات المناولة والتخلص المناسبة لضمان السلامة.
| رموز الخطر | لا أحد |
| وصف الأمان | سمية منخفضة |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2915.29.10 |
| فئة الخطر | لم يتم تصنيف ملح الأمونيوم لحمض الأسيتيك |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة |
طرق تصنيع خلات الأمونيوم
هناك عدة طرق لتصنيع ملح الأمونيوم من حمض الأسيتيك. الطريقة الشائعة هي خلط حمض الأسيتيك مع محلول مائي من كربونات الأمونيوم . التفاعل بينهما ينتج ملح الأمونيوم وماء الخل. تتطلب هذه الطريقة التحكم في درجة الحرارة والضغط أثناء التفاعل.
وفي طريقة أخرى، يضيف الكيميائيون حمض الأسيتيك تدريجيًا إلى محلول الأمونيا مع التحريك حتى الوصول إلى الرقم الهيدروجيني المطلوب. تعمل عملية التعادل هذه على تحويل حمض الأسيتيك إلى ملح الأمونيوم الخاص بحمض الأسيتيك. يعتبر الخلط الدقيق والتحكم في درجة الحموضة ضروريين أثناء هذا التفاعل.
استخدم هيدروكسيد الأمونيوم لتصنيع ملح الأمونيوم من حمض الأسيتيك من خلال دمجه مع حمض الأسيتيك ، مما يؤدي إلى تكوين ملح الأمونيوم من حمض الأسيتيك والماء. مراقبة التقدم في هذا التفاعل حتى يكتمل.
يخلط أنهيدريد الخل مع هيدروكسيد الأمونيوم أو الأمونيا لتحضير ملح الأمونيوم لحمض الأسيتيك. يؤدي التفاعل بين هذه الكواشف إلى تكوين ملح الأمونيوم من حمض الأسيتيك.
تذكر أنه من الضروري إجراء تخليق ملح الأمونيوم من حمض الأسيتيك في منطقة جيدة التهوية واتباع تدابير السلامة المناسبة. طوال عملية التوليف، ضمان المعالجة السليمة وتخزين المواد الكيميائية.
استخدامات خلات الأمونيوم
يجد ملح الأمونيوم لحمض الخليك تطبيقات مختلفة في صناعات مختلفة بسبب خصائصه المتنوعة. فيما يلي بعض الاستخدامات الشائعة:
- يقوم ملح الأمونيوم الموجود في حمض الأسيتيك بتخزين المحاليل ويحافظ على مستوى درجة الحموضة ثابتًا في المختبرات الكيميائية والبيولوجية.
- تستخدم الطرق التحليلية مثل التحليل اللوني وقياس الطيف الكتلي ملح الأمونيوم لحمض الأسيتيك ككاشف للتأين وفصل المركبات.
- تستخدم البيولوجيا الجزيئية ملح الأمونيوم الموجود في حمض الأسيتيك لترسيب الحمض النووي أثناء إجراءات التنقية، وبالتالي إزالة الملوثات والشوائب.
- يشارك ملح الأمونيوم الموجود في حمض الأسيتيك في العديد من التفاعلات الكيميائية، حيث يعمل كمصدر لأيونات الخلات في التخليق العضوي وتفاعلات الأسترة والعمليات التحفيزية.
- في الزراعة، يعمل ملح الأمونيوم الموجود في حمض الأسيتيك كمصدر للنيتروجين في الأسمدة، مما يعزز نمو النبات وتطوره.
- تستخدم الصناعات النسيجية ملح الأمونيوم الموجود في حمض الأسيتيك لصبغ وطباعة الأقمشة، وبالتالي تحسين ثبات اللون عن طريق تثبيت الأصباغ على القماش.
- تعتمد صناعة المواد الغذائية ملح الأمونيوم من حمض الأسيتيك كمضاف غذائي، وينظم الحموضة للتحكم في درجة الحموضة لمختلف المنتجات الغذائية.
- في تقنيات التحليل الكيميائي مثل HPLC (تحليل كروماتوجرافي سائل عالي الأداء)، يسهل ملح الأمونيوم الموجود في حمض الأسيتيك فصل المركبات واكتشافها.
بشكل عام، يعتبر ملح الأمونيوم لحمض الأسيتيك مركبًا متعدد الاستخدامات تتراوح استخداماته من التطبيقات المختبرية إلى الزراعة وصناعة الأغذية. خصائصه الفريدة تجعله عنصرا هاما في مختلف العمليات والمنتجات.
أسئلة:
س: ما عدد ذرات الهيدروجين الموجودة في جزيء خلات الأمونيوم NH4C2H3O2؟
ج: توجد أربع ذرات هيدروجين في جزيء واحد من ملح الأمونيوم من حمض الخليك (NH4C2H3O2).
س: هل خلات الأمونيوم قابلة للذوبان؟
ج: نعم، ملح الأمونيوم لحمض الخليك قابل للذوبان في الماء.
س: ما هي صيغة خلات الأمونيوم؟
ج: صيغة ملح الأمونيوم لحمض الأسيتيك هي NH4C2H3O2.
س: هل خلات الأمونيوم قابلة للذوبان في الماء؟
ج: نعم، ملح الأمونيوم لحمض الخليك قابل للذوبان في الماء.
س: كيفية تحضير 1M خلات الأمونيوم؟
ج: لتحضير 1M من ملح الأمونيوم من حمض الأسيتيك، قم بإذابة الكمية المناسبة من خلات الأمونيوم في الماء للحصول على تركيز 1 مول لكل لتر (M).
س: ما عدد مولات الأيونات الكلية التي يتم إطلاقها عند إذابة 0.624 مول من خلات الأمونيوم في الماء؟
ج: عند إذابة 0.624 مول من ملح الأمونيوم من حمض الأسيتيك في الماء، يتم إطلاق إجمالي 1.248 مول من الأيونات (NH4+ وC2H3O2-).
س: ما هو الوزن الجزيئي الدقيق لخلات الأمونيوم (NH4OAc)؟
ج: يبلغ الوزن الجزيئي الدقيق لملح الأمونيوم لحمض الأسيتيك (NH4OAc) حوالي 77.0825 جرامًا لكل مول.
س: كيفية صنع خلات الأمونيوم 5M؟
ج: لتحضير 5M من ملح الأمونيوم من حمض الأسيتيك، قم بإذابة الكمية المناسبة من خلات الأمونيوم في الماء للوصول إلى تركيز 5 مول لكل لتر (M).
س: ما هو pKa لحمض الأسيتيك وpKb لهيدروكسيد الأمونيوم؟
ج: يبلغ pKa لحمض الأسيتيك حوالي 4.75، ويبلغ pKb لملح الأمونيوم لحمض الأسيتيك حوالي 4.25.
