حمض الكلوريك (HClO3) هو حمض قوي وغير مستقر يمكن إنتاجه عن طريق خلط ثاني أكسيد الكلور مع الماء. يتم استخدامه في عوامل التبييض والتطهير، وكذلك في إنتاج المتفجرات.
| اسم الأيوباك | حمض الكلوريك |
| الصيغة الجزيئية | حمض الهيدروكلوريك3 |
| CAS رقم | 7790-93-4 |
| المرادفات | حمض البيركلوريك، كلورات. محلول حمض الكلوريك حمض الكلوريك (V)؛ كلورات الهيدروجين؛ ثلاثي كلورات الهيدروجين |
| إنتشي | InChI=1S/ClHO3/c2-1(3)4/ساعة(H,2,3,4) |
تحظى خصائص حمض الكلوريك (HClO3) باهتمام خاص لدى الكيميائيين والمهندسين بسبب تطبيقاته الصناعية العديدة.
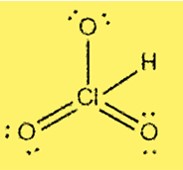
هيكل لويس HClO3
يوضح هيكل لويس لـ HClO3 أن الكلور هو الذرة المركزية المرتبطة بثلاث ذرات أكسجين وذرة هيدروجين واحدة. يحتوي الكلور على 7 إلكترونات تكافؤ، وكل أكسجين يحتوي على 6 إلكترونات تكافؤ. يتضمن الهيكل ثلاث روابط مفردة ورابطة مزدوجة بين ذرات الكلور والأكسجين.
صيغة حمض الكلوريك (HClO3).
الصيغة الكيميائية لحمض الكلوريك (HClO3) هي HClO3. وهو حمض غير عضوي يحتوي على ذرة كلور واحدة، وذرة هيدروجين واحدة، وثلاث ذرات أكسجين. يتم استخدام صيغة حمض الكلوريك (HClO3) لحساب قياس العناصر الكيميائية وتركيز المحاليل التي تحتوي على الحمض.
حمض الكلوريك (HClO3) الكتلة المولية
الكتلة المولية لحمض الكلوريك (HClO3) هي 84.46 جم/مول. وهو حمض خفيف نسبيا مقارنة بالأحماض غير العضوية الأخرى، مثل حمض الكبريتيك، الذي تبلغ كتلته المولية 98.08 جم / مول. تعد الكتلة المولية لحمض الكلوريك (HClO3) معلمة مهمة في حساب التركيز وقياس العناصر الكيميائية للمحاليل التي تحتوي على الحمض.
درجة غليان حمض الكلوريك (HClO3)
حمض الكلوريك (HClO3) درجة غليانه 40.5 درجة مئوية. وهو حمض متطاير للغاية يمكن أن يتحلل عند درجات حرارة عالية، مما يجعل من الصعب التعامل معه وتخزينه. تعتبر نقطة الغليان المنخفضة لحمض الكلوريك (HClO3) من الاعتبارات المهمة في تصميم المعدات والعمليات التي تتضمن استخدام الحمض.
نقطة انصهار حمض الكلوريك (HClO3)
لا يحتوي حمض الكلوريك (HClO3) على نقطة انصهار محددة جيدًا. يمكن أن يتحلل قبل أن يصل إلى نقطة الانصهار، ويطلق غاز الأكسجين ويترك وراءه بقايا الكلورات. يرجع عدم وجود نقطة انصهار مميزة إلى عدم استقرار حمض الكلوريك (HClO3).
كثافة حمض الكلوريك (HClO3) جم/مل
كثافة حمض الكلوريك (HClO3) هي 1.97 جم/سم3. وهو حمض كثيف نسبياً مقارنة بالأحماض غير العضوية الأخرى، مثل حمض الهيدروكلوريك الذي تبلغ كثافته 1.18 جم/سم3. تعد الكثافة العالية لحمض الكلوريك (HClO3) أحد الاعتبارات المهمة في تصميم العمليات التي تتضمن معالجة الحمض ونقله.
الوزن الجزيئي لـ حمض الكلوريك (HClO3)
الوزن الجزيئي لحمض الكلوريك (HClO3) هو 84.46 جم/مول. وهو مجموع الأوزان الذرية للعناصر المكونة له: ذرة كلور واحدة، ذرة هيدروجين واحدة وثلاث ذرات أكسجين. يعد الوزن الجزيئي لحمض الكلوريك (HClO3) معلمة مهمة في حساب التركيز وقياس العناصر الكيميائية للمحاليل التي تحتوي على الحمض.
هيكل حمض الكلوريك (HClO3)
يتكون هيكل حمض الكلوريك من ذرة كلور مركزية مرتبطة بثلاث ذرات أكسجين وذرة هيدروجين واحدة. يحتوي الجزيء على هندسة رباعية السطوح، مع وجود ذرة الكلور في مركز رباعي السطوح. يتم ترتيب ذرات الأكسجين الثلاث حول ذرة الكلور في ترتيب مستو ثلاثي، في حين ترتبط ذرة الهيدروجين بإحدى ذرات الأكسجين. إن بنية حمض الكلوريك (HClO3) مهمة لفهم خواصه الكيميائية وتفاعليته.
| مظهر | سائل شفاف أو مصفر |
| جاذبية معينة | 1.97 |
| لون | عديم اللون إلى الأصفر |
| يشم | عديم الرائحة |
| الكتلة المولية | 84.46 جرام/مول |
| كثافة | 1.68 جم/سم3 |
| نقطة الانصهار | تتحلل قبل الذوبان |
| نقطة الغليان | 40.5 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في معظم المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| PKa | -0.6 |
| الرقم الهيدروجيني | <1 |
حمض الكلوريك (HClO3) السلامة والمخاطر
يمثل حمض الكلوريك (HClO3) العديد من مخاطر السلامة ويجب التعامل معه بحذر. وهو عامل مؤكسد قوي يمكن أن يتفاعل بعنف مع العديد من المواد العضوية، بما في ذلك الوقود وعوامل الاختزال والسوائل القابلة للاشتعال. يمكن أن يسبب حروقًا شديدة في الجلد والعينين عند ملامسته وقد يؤدي إلى تآكل الأسطح المعدنية. استنشاق أبخرةه قد يسبب تهيج الجهاز التنفسي والسعال. ونظرًا لطبيعته التفاعلية، يجب تخزينه والتعامل معه في منطقة جيدة التهوية، بعيدًا عن المواد الكيميائية الأخرى. يجب ارتداء معدات الحماية، مثل القفازات والنظارات الواقية وجهاز التنفس، عند التعامل مع حمض الكلوريك لتجنب التعرض له. في حالة ملامسة الجلد أو العين، يجب طلب العناية الطبية الفورية.
| رموز الخطر | عامل مؤكسد |
| وصف الأمان | تجنب ملامسة الجلد والعينين؛ ارتداء معدات الحماية |
| معرفات | الأمم المتحدة 3084 |
| رمز النظام المنسق | 2811.19 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | تآكل. يمكن أن يسبب حروقًا شديدة في الجلد والعينين |
طرق تصنيع حمض الكلوريك (HClO3)
يمكن تصنيع حمض الكلوريك بعدة طرق، بما في ذلك تفاعل غاز الكلور مع هيدروكسيد الصوديوم أو كلورات الصوديوم. الطريقة الشائعة هي تفاعل كلورات الصوديوم مع حمض الهيدروكلوريك.
يتضمن تفاعل تصنيع حمض الكلوريك تفاعل كلورات الصوديوم (NaClO3) مع حمض الهيدروكلوريك (HCl) في عملية مكونة من خطوتين. تتضمن الخطوة الأولى تحويل كلورات الصوديوم إلى كلوريت الصوديوم (NaClO2) وغاز ثاني أكسيد الكلور (ClO2) في وجود محفز حمضي. وفي الخطوة الثانية، يتفاعل غاز ثاني أكسيد الكلور مع حمض الهيدروكلوريك الزائد لتكوين حمض الكلوريك وغاز الكلور.
هناك طريقة أخرى لتصنيع حمض الكلوريك تتضمن التحليل الكهربائي لمحلول يحتوي على كلوريد الصوديوم وحمض النيتريك وحمض الكبريتيك. تنتج هذه العملية غاز الكلور الذي يتفاعل مع الماء لتكوين حمض الكلوريك.
لإنتاج حمض الكلوريك، يمكن تفاعل كلورات البوتاسيوم مع حمض الكبريتيك ومن ثم يتم تقطير الخليط الناتج.
يتطلب تصنيع حمض الكلوريك معالجة دقيقة للكواشف بسبب خطر التفاعلات العنيفة والطبيعة المسببة للتآكل للأحماض المعنية. من المهم اتباع بروتوكولات السلامة المناسبة والتعامل مع المواد في منطقة جيدة التهوية باستخدام معدات الحماية المناسبة.
استخدامات حمض الكلوريك (HClO3)
حمض الكلوريك (HClO3) له العديد من التطبيقات في مختلف الصناعات بسبب خصائصه المؤكسدة القوية. بعض استخداماته هي:
- إنتاج مواد كيميائية أخرى: يعمل حمض الكلوريك كوسيط في إنتاج مواد كيميائية أخرى، بما في ذلك حمض البيركلوريك، والكلورات، والبيركلورات.
- عامل التبييض: تستخدم صناعة اللب والورق حمض الكلوريك كعامل تبييض.
- مطهر: يعمل حمض الكلوريك كمطهر في صناعة الأغذية والمشروبات لتطهير المعدات والأسطح.
- التنميش: تستخدم صناعة أشباه الموصلات حمض الكلوريك كعنصر تنميش لإزالة طبقات المواد غير المرغوب فيها من رقائق أشباه الموصلات.
- الكاشف المختبري: يستخدم حمض الكلوريك ككاشف مختبري في الكيمياء التحليلية والتخليق العضوي.
- العامل المؤكسد: يستخدم حمض الكلوريك كعامل مؤكسد في تفاعلات الكيمياء العضوية.
- وقود الصواريخ: يعمل حمض الكلوريك كعامل مؤكسد في وقود الصواريخ.
- معالجة المياه: يستخدم حمض الكلوريك في معالجة المياه للتحكم في نمو الطحالب والبكتيريا.
أسئلة:
س: هل حمض الكلوريك حمض قوي؟
ج: نعم، حمض الكلوريك (HClO3) حمض قوي.
س: ما الصيغة التي تمثل حمض الكلوريك؟
ج: صيغة حمض الكلوريك هي HClO3.
س: اشرح لماذا حمض الهيدروكلوريك هو حمض الهيدروكلوريك وHClO3 هو حمض الكلوريك؟
ج: أسماء الأحماض الثنائية (المركبات التي تحتوي على عنصرين فقط) عادة ما تكون مشتقة من اسم الأنيون، مع اللاحقة -ic للأنيون الأكثر شيوعاً و-ous للأنيون الأقل شيوعاً. في حالة حمض الهيدروكلوريك، يكون الأنيون هو كلوريد (Cl-)، لذلك يسمى الحمض حمض الهيدروكلوريك. في حالة حمض الهيدروكلوريك (HClO3)، يكون الأنيون هو كلورات (ClO3-)، لذلك يسمى الحمض بحمض الكلوريك.
س: ما هي صيغة حمض الكلوريك؟
ج: صيغة حمض الكلوريك هي HClO3.
س: هل حمض الكلوريك أيوني أم جزيئي؟
ج: حمض الكلوريك جزيئي لأنه يتكون من ذرات الهيدروجين والكلور والأكسجين المرتبطة تساهميًا.
