حمض الكلوروسيتيك هو مركب كيميائي له الصيغة CH₂ClCOOH. يتم استخدامه في مختلف التطبيقات الصناعية، بما في ذلك إنتاج الأصباغ والمستحضرات الصيدلانية ومبيدات الأعشاب.
| اسم الأيوباك | حمض الكلوروسيتيك |
| الصيغة الجزيئية | CH₂ClCOOH |
| CAS رقم | 79-11-8 |
| المرادفات | حمض أحادي كلورو أسيتيك، MCA، حمض كلوروإيثانويك، حمض كلورو إيثيل |
| إنتشي | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4.5) |
خصائص حمض الكلوروسيتيك
صيغة حمض الكلوروسيتيك
صيغة حمض الكلوروسيتيك هي CH₂ClCOOH. ويتكون من ذرتين كربون وثلاث ذرات هيدروجين وذرة كلور وذرتين أكسجين. ترتبط ذرة الكلور بإحدى ذرات الكربون، بينما ترتبط ذرة الكربون الأخرى بمجموعة الحمض الكربوكسيلي (-COOH).
الكتلة المولية لحمض الكلوروسيتيك
يتم حساب الكتلة المولية لحمض أحادي كلورو أسيتيك عن طريق إضافة الكتل الذرية للعناصر المكونة له. يحتوي حمض أحادي كلورو أسيتيك على كتلة مولية تبلغ حوالي 94.5 جرامًا لكل مول. ويتم تحديده من خلال النظر في الكتل الذرية للكربون (C)، والهيدروجين (H)، والكلور (Cl) والأكسجين (O) الموجود في المركب.
نقطة غليان حمض الكلوروسيتيك
تبلغ درجة غليان حمض أحادي كلورو أسيتيك حوالي 189 درجة مئوية. عند درجة الحرارة هذه، يتحول حمض أحادي كلورو أسيتيك السائل إلى الطور الغازي. تتأثر نقطة غليان حمض أحادي كلورو أسيتيك بالقوى الجزيئية بين جزيئاته والضغط الجوي.
نقطة انصهار حمض الكلوروسيتيك
تبلغ نقطة انصهار حمض أحادي كلورو أسيتيك حوالي 62 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها الشكل الصلب لحمض أحادي كلورو أسيتيك إلى الحالة السائلة. قد تختلف نقطة الانصهار قليلاً اعتمادًا على نقاء العينة والظروف التي يتم قياسها فيها.
كثافة حمض الكلوروسيتيك جم / مل
تبلغ كثافة حمض أحادي كلورو أسيتيك حوالي 1.58 جرام لكل مليلتر. يشير إلى كتلة حمض أحادي كلورو أسيتيك لكل وحدة حجم. تتأثر كثافة حمض أحادي كلورو أسيتيك بعوامل مثل درجة الحرارة والضغط.
الوزن الجزيئي لحمض الكلوروسيتيك
يبلغ الوزن الجزيئي لحمض أحادي كلورو أسيتيك حوالي 94.5 جرامًا لكل مول. وهو يمثل مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء حمض أحادي كلورو أسيتيك. الوزن الجزيئي مفيد في الحسابات المختلفة المتعلقة بالمركب، مثل تحديد التركيزات أو الكميات المولية.
هيكل حمض الكلوروسيتيك
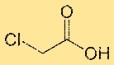
يحتوي حمض أحادي كلورو أسيتيك على بنية تتكون من ذرة كربون مركزية مرتبطة بذرة الكلور، ومجموعة حمض الكربوكسيل (-COOH)، وذرتي هيدروجين. ترتبط ذرة الكلور مباشرة بذرة الكربون. يؤثر الترتيب الهيكلي لحمض أحادي كلورو أسيتيك على خواصه الكيميائية وتفاعليته.
ذوبان حمض الكلوروسيتيك
حمض أحادي كلورو أسيتيك قابل للذوبان بشكل معتدل في الماء. فهو يشكل روابط هيدروجينية مع جزيئات الماء، مما يسمح له بالذوبان إلى حد ما. تتأثر قابلية ذوبان حمض أحادي كلورو أسيتيك بعوامل مثل درجة الحرارة ودرجة الحموضة ووجود مواد أخرى في المحلول.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1.58 جرام/مل |
| لون | عديم اللون |
| يشم | خل |
| الكتلة المولية | 94.5 جرام/مول |
| كثافة | 1.58 جرام/مل |
| نقطة الانصهار | 62 درجة مئوية |
| نقطة الغليان | 189 درجة مئوية |
| نقطة فلاش | 111 درجة مئوية |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في الإيثانول والأثير والكلوروفورم |
| ضغط البخار | 0.23 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 3.3 (الهواء = 1) |
| pKa | 2.87 |
| الرقم الهيدروجيني | 1.5 – 2.5 |
سلامة ومخاطر حمض الكلوروسيتيك
يشكل حمض أحادي كلورو أسيتيك العديد من مخاطر السلامة ويجب التعامل معه بحذر. وهو يسبب تآكل الجلد والعينين والجهاز التنفسي، ويسبب الحروق والتهيج. الاتصال المباشر يمكن أن يسبب تلفًا خطيرًا في الجلد والعين. استنشاق أبخرةه أو ضبابه قد يهيج الجهاز التنفسي. كما أنه ضار إذا تم ابتلاعه، ويسبب اضطرابًا في الجهاز الهضمي. يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند العمل مع حمض أحادي كلورو أسيتيك. التهوية الكافية أمر بالغ الأهمية لتقليل التعرض. في حالة ملامسة الجلد أو العينين، يعد الشطف الفوري بالماء ضروريًا ويجب طلب العناية الطبية.
| رموز الخطر | تآكل، سامة |
| وصف الأمان | تجنب الاتصال. استخدم معدات الحماية الشخصية. التأكد من التهوية الكافية. التعامل مع الرعاية. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1751 |
| رمز النظام المنسق | 2915.12.00 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | ثانيا |
| تسمم | سامة عن طريق البلع والاستنشاق وامتصاص الجلد. يسبب حروقاً شديدة وتلفاً في العين. ضارة إذا ابتلعت. |
طرق تصنيع حمض الكلوروسيتيك
تسمح الطرق المختلفة بتخليق حمض أحادي كلورو أسيتيك.
تتضمن الطريقة شائعة الاستخدام لتصنيع حمض أحادي كلورو أسيتيك معالجة حمض الأسيتيك بعامل مهلجن، عادة غاز الكلور (Cl₂)، في وجود محفز مثل حمض الكبريتيك (H₂SO₄). وينتج عن التفاعل بين حمض الأسيتيك والكلور استبدال ذرة الهيدروجين في جزيء حمض الأسيتيك بذرة الكلور، وبالتالي تكوين حمض الخليك أحادي الكلور.
تتضمن الطريقة الأخرى التفاعل بين كلوريد الأسيتيل (CH₃COCl) والماء (H₂O). يتحلل الماء كلوريد الأسيتيل، مما يؤدي إلى تكوين حمض أحادي كلورو أسيتيك. هذا التفاعل طارد للحرارة ويتطلب الحذر عند تنفيذه.
يحدث تكوين حمض أحادي كلورو أسيتيك من خلال كربوكسيل الكلوروميثان (CH₃Cl) باستخدام ثاني أكسيد الكربون (CO₂) في وجود قاعدة قوية مثل هيدروكسيد الصوديوم (NaOH) . يتم التفاعل عن طريق الاستبدال المحب للنواة، حيث تحل مجموعة الكربوكسيلات (-COOH) لجزيء ثاني أكسيد الكربون محل أيون الكلوريد.
تذكر أن التعامل السليم واحتياطات السلامة أمر بالغ الأهمية لطرق التوليف هذه بسبب الطبيعة المسببة للتآكل والسامة لحمض أحادي كلورو أسيتيك. ضمان التحكم الدقيق في ظروف التفاعل والتخلص السليم من المنتجات الثانوية والنفايات لضمان عمليات التوليف آمنة وفعالة.
استخدامات حمض الكلوروسيتيك
يجد حمض أحادي كلورو أسيتيك تطبيقات في مختلف الصناعات نظرًا لخصائصه المتنوعة. فيما يلي بعض الاستخدامات الشائعة:
- إنتاج مبيدات الأعشاب: حمض أحادي كلورو أسيتيك هو عنصر أساسي في تركيب مبيدات الأعشاب، مثل الغليفوسات. يساعد على منع نمو النباتات والأعشاب الضارة غير المرغوب فيها في الزراعة.
- التصنيع الدوائي: يعد بمثابة لبنة أساسية في إنتاج المركبات الصيدلانية، بما في ذلك المضادات الحيوية والمطهرات والمسكنات. يساعد حمض أحادي كلورو أسيتيك على تعديل وتعزيز الخصائص المرغوبة لهذه الأدوية.
- صناعة الأصباغ والأصباغ: يستخدم المصنعون حمض أحادي كلورو أسيتيك في إنتاج الأصباغ والأصباغ. يساعد في تركيب الأصباغ المستخدمة في المنسوجات والدهانات والأحبار وغيرها من التطبيقات الزخرفية.
- الوسطيات الكيميائية: يعمل كمركب وسيط رئيسي في إنتاج المواد الكيميائية المختلفة. يتضمن تخليق البوليمرات والمذيبات والملدنات والمركبات العضوية الأخرى استخدام هذه الوسائط.
- تصنيع المواد الخافضة للتوتر السطحي: يلعب حمض أحادي كلورو أسيتيك دورًا في إنتاج المواد الخافضة للتوتر السطحي، وهي مكونات أساسية للمنظفات ومواد التنظيف ومنتجات العناية الشخصية. تساعد المواد الخافضة للتوتر السطحي على تقليل التوتر السطحي بين السوائل، مما يسمح بقدرات أفضل على الخلط والتشتيت.
- التطبيقات البحثية والمخبرية: تستخدم مختبرات الأبحاث حمض أحادي كلورو أسيتيك ككاشف للتفاعلات الكيميائية، وخاصة في التخليق العضوي والإجراءات التحليلية.
- التفاعلات الكيميائية والتخليق العضوي: إنه بمثابة كاشف مهم في التفاعلات العضوية المختلفة، مثل الاستبدالات النووية، والأسترة، وتفاعلات الكربوكسيلة.
- الطلاء الكهربائي: يستخدم حمض أحادي كلورو أسيتيك في عمليات الطلاء الكهربائي، حيث يعمل كمصدر للكلور لترسيب الطلاء المعدني على الأسطح.
تسلط هذه التطبيقات المتنوعة الضوء على أهمية حمض أحادي كلورو أسيتيك في جميع الصناعات، مما يساهم في تطوير العديد من المنتجات والعمليات الكيميائية.
أسئلة:
س: ما هي قيمة Ka لمحلول 0.15 M من حمض الكلوروسيتيك ودرجة الحموضة 1.86؟
ج: يمكن حساب قيمة Ka لحمض أحادي كلورو أسيتيك باستخدام قيمة الرقم الهيدروجيني وهي تقريبًا 1.4 × 10^-3.
س: هل حمض الكلوروسيتيك قوي أم ضعيف؟
ج: حمض أحادي كلورو أسيتيك حمض ضعيف.
س: ماذا يعطي الصوديوم 4-كلوروفينولات + حمض الكلوروسيتيك؟
ج: تفاعل 4-كلوروفينولات الصوديوم مع حمض أحادي كلورو أسيتيك يعطي حمض 4-كلوروفينوكسي أسيتيك وكلوريد الصوديوم.
س: ما هو كا حمض الكلوروسيتيك؟
ج: تبلغ قيمة Ka لحمض أحادي كلورو أسيتيك حوالي 1.4 × 10^-3.
س: هل حمض الكلوروسيتيك أحادي البروتين؟
ج: نعم، حمض أحادي كلورو أسيتيك أحادي البروتين، مما يعني أنه يمكن أن يتخلى فقط عن بروتون واحد (أيون H+) في التفاعل الكيميائي.
س: ما هو ثابت التأين لحمض الكلوروسيتيك؟
ج: ثابت التأين (Ka) لحمض أحادي كلورو أسيتيك يبلغ حوالي 1.4 × 10^-3.
س: هل حمض الكلوروسيتيك أقوى من حمض الأسيتيك؟
ج: نعم، حمض أحادي كلورو أسيتيك أقوى من حمض الأسيتيك.
س: لماذا حمض الكلوروسيتيك أقوى من حمض الأسيتيك؟
ج: إن وجود ذرة الكلور في حمض أحادي كلورو أسيتيك يزيد من قدرته على جذب الإلكترونات، مما يجعله أكثر حامضية من حمض الأسيتيك.
س: ما هي الكتلة المولية لحمض الكلوروسيتيك؟
ج: تبلغ الكتلة المولية لحمض أحادي كلورو أسيتيك حوالي 94.5 جرامًا لكل مول.
