حمض الكلوروسلفونيك هو حمض قوي له الصيغة HSO₃Cl. وهو شديد التآكل، ويستخدم ككاشف في التخليق العضوي وكعامل سلفنة لصناعة المنظفات والأصباغ.
| اسم الأيوباك | حمض الكلوروسلفونيك |
| الصيغة الجزيئية | HSO₃Cl |
| CAS رقم | 7790-94-5 |
| المرادفات | كلوروهيدرين الكبريتيك، حمض الكلوروسلفوريك، حمض الكلوروسلفونيك |
| إنتشي | InChI=1S/ClH2O3S/c1-5(2,3)4/h(H,2,3,4) |
خصائص حمض الكلوروسلفونيك
صيغة حمض الكلوروسلفونيك
صيغة حمض الكلوروسلفونيك هي HSO₃Cl. ويتكون من ذرة هيدروجين واحدة، وذرة كبريت واحدة، وثلاث ذرات أكسجين، وذرة كلور واحدة.
الكتلة المولية لحمض الكلوروسلفونيك
يتم حساب الكتلة المولية لحمض الكلوروسلفوريك عن طريق إضافة الكتل الذرية للذرات المكونة له. تبلغ الكتلة المولية لـ HSO₃Cl حوالي 116.5 جرامًا لكل مول.
نقطة غليان حمض الكلوروسلفونيك
درجة غليان حمض الكلوروسلفوريك مرتفعة نسبيا. تبلغ درجة الحرارة حوالي 151 درجة مئوية (304 درجة فهرنهايت). عند درجة الحرارة هذه، يتغير حمض الكلوروسلفوريك من الطور السائل إلى الطور الغازي.
نقطة انصهار حمض الكلوروسلفونيك
تبلغ درجة انصهار حمض الكلوروسلفوريك حوالي -82 درجة مئوية (-116 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها الشكل الصلب لحمض الكلوروسلفوريك إلى سائل.
كثافة حمض الكلوروسلفونيك جم / مل
تبلغ كثافة حمض الكلوروسلفوريك حوالي 1.75 جرام لكل مليلتر (جم / مل) في درجة حرارة الغرفة. وهذا يعني أن حجمًا معينًا من حمض الكلوروسلفوريك ثقيل نسبيًا مقارنة بحجم مساوٍ له من الماء.
الوزن الجزيئي لحمض الكلوروسلفونيك
يتم حساب الوزن الجزيئي لحمض الكلوروسلفوريك عن طريق إضافة الأوزان الذرية لجميع الذرات الموجودة في صيغته الكيميائية. يبلغ الوزن الجزيئي لحمض الكلوروسلفوريك حوالي 116.5 جرامًا لكل مول.
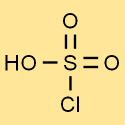
هيكل حمض الكلوروسلفونيك
يتكون هيكل حمض الكلوروسلفوريك من ذرة كبريت واحدة مرتبطة بثلاث ذرات أكسجين وذرة كلور واحدة. ترتبط ذرة الهيدروجين بإحدى ذرات الأكسجين. يمنح هذا الهيكل حمض الكلوروسلفوريك خصائصه الفريدة وتفاعله.
ذوبان حمض الكلوروسلفونيك
حمض الكلوروسلفوريك قابل للذوبان بشكل كبير في الماء. يذوب بسهولة في الماء، ويشكل محلولًا حمضيًا قويًا. ترجع قابلية ذوبان حمض الكلوروسلفوريك إلى طبيعته القطبية وتكوين روابط هيدروجينية مع جزيئات الماء.
| مظهر | عديم اللون إلى السائل الأصفر |
| جاذبية معينة | 1.75 (عند 20 درجة مئوية) |
| لون | عديم اللون إلى الأصفر |
| يشم | رائحة قوية ونفاذة |
| الكتلة المولية | 116.5 جرام/مول |
| كثافة | 1.75 جم/مل (عند 20 درجة مئوية) |
| نقطة الانصهار | -82 درجة مئوية (-116 درجة فهرنهايت) |
| نقطة الغليان | 151 درجة مئوية (304 درجة فهرنهايت) |
| نقطة فلاش | غير متاح |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل الكلوروفورم، ثنائي كلورو ميثان، النيتروبنزين |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | -2.6 |
| الرقم الهيدروجيني | حمضية جدًا (الرقم الهيدروجيني <1) |
ملاحظة: يرجى الأخذ في الاعتبار أن القيم الواردة في هذا الجدول هي خصائص عامة مرتبطة بحمض الكلوروسلفوريك. قد تختلف القيم الفعلية قليلاً حسب الظروف المحددة ونقاء المركب.
سلامة ومخاطر حمض الكلوروسلفونيك
يشكل حمض الكلوروسلفوريك مخاطر كبيرة على السلامة ويجب التعامل معه بحذر شديد. وهو شديد التآكل ويمكن أن يسبب حروقًا شديدة عند ملامسته للجلد والعينين والجهاز التنفسي. قد يسبب الاستنشاق أو البلع مخاطر صحية خطيرة بما في ذلك ضيق التنفس وتلف الأعضاء الداخلية. يتفاعل بعنف مع الماء، ويطلق غازات سامة ويولد الحرارة. توجد مخاطر الحريق والانفجار عند ملامسة المواد العضوية. يجب استخدام معدات الحماية الشخصية الكافية، مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي، عند العمل مع حمض الكلوروسبريتيك. تعتبر تدابير التهوية والاحتواء المناسبة ضرورية لتقليل التعرض وضمان السلامة عند التعامل مع هذه المادة الخطرة.
| رموز الخطر | أكالة (C)، ضارة (Xn) |
| وصف الأمان | – التعامل بحذر شديد\n- استخدام معدات الحماية المناسبة\n- تجنب ملامسة الجلد والعينين والاستنشاق\n- يخزن في منطقة جيدة التهوية\n- لا يخلط مع الماء أو المواد التفاعلية |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1751 |
| رمز النظام المنسق | 28121100 |
| فئة الخطر | الفئة 8 – المواد المسببة للتآكل |
| مجموعة التعبئة | مجموعة التعبئة الثانية |
| تسمم | سام جدا؛ يسبب حروقًا شديدة وأضرارًا في الجهاز التنفسي |
طرق تصنيع حمض الكلوروسلفونيك
هناك عدة طرق لتجميع حمض الكلوروسلفوريك. تتضمن الطريقة الشائعة التفاعل بين ثالث أكسيد الكبريت (SO₃) وكلوريد الهيدروجين (HCl) . في هذه العملية، يتم غلي محلول حمض الهيدروكلوريك مع غاز SO₃ لتوليد حمض الكلوروسلفوريك. يعد التحكم الدقيق في درجة الحرارة وظروف التفاعل ضروريًا نظرًا لارتفاع درجة حرارة التفاعل.
وفي طريقة أخرى، ينتج عن تفاعل غاز الكلور (Cl₂) مع حمض الكبريتيك (H₂SO₄) حمض الكلوروسلفوريك. يؤدي مرور غاز الكلور عبر حمض الكبريتيك المركز إلى تكوين حمض الكلوروسلفوريك. لضمان السلامة، يجب عليك اتخاذ التدابير المناسبة ضد هذا التفاعل الطارد للحرارة.
بالإضافة إلى ذلك، يتضمن تحضير حمض الكلوروسلفوريك تفاعل حمض الكبريتيك مع كلوريد السلفوريل (SO₂Cl₂). يتفاعل كلوريد الكبريتيل مع حمض الكبريتيك لتكوين حمض الكلوروسلفوريك وغاز كلوريد الهيدروجين.
تجدر الإشارة إلى أن تخليق حمض الكلوروسلفوريك يجب أن يتم في مختبر مجهز تجهيزًا جيدًا، باتباع بروتوكولات السلامة المناسبة. يجب على الكيميائي استخدام معدات الحماية، مثل القفازات والنظارات الواقية وغطاء الرأس، لضمان سلامتها.
تسمح طرق التوليف هذه للكيميائيين بإنتاج حمض الكلوروسلفوريك، وهو مركب متعدد الاستخدامات يستخدم في مجموعة متنوعة من التطبيقات الصناعية، بما في ذلك التوليف العضوي، وتفاعلات السلفنة، وإنتاج الأصباغ والمنظفات.
استخدامات حمض الكلوروسلفونيك
يجد حمض الكلوروسلفوريك تطبيقات واسعة في مختلف الصناعات بسبب خصائصه المتنوعة. وهذه بعض استخداماته:
- يشارك حمض الكلوروسلفوريك بشكل فعال في العديد من تفاعلات التخليق العضوي، بما في ذلك الأسترة والسلفونات والهالوجينات، حيث يعمل ككاشف قوي. يقدم بكفاءة المجموعات الوظيفية ويعدل الهياكل الجزيئية.
- في صناعة الأصباغ، يلعب حمض الكلوروسلفوريك دورًا حاسمًا لأنه يعمل على سلفونات المركبات العطرية بشكل فعال، مما يسمح بتكوين مجموعات حمض السلفونيك. تعمل هذه المجموعات على تحسين ذوبان الأصباغ وتحسين خصائص اللون.
- في إنتاج المنظفات، يعمل حمض الكلوروسلفوريك بشكل فعال كعامل سلفنة أثناء تخليق مركبات المنظفات. فهو يساهم بشكل فعال في تكوين المواد الخافضة للتوتر السطحي، وتحسين خصائص التنظيف والرغوة.
- تستخدم صناعة الأدوية حمض الكلوروسلفوريك على نطاق واسع كعنصر نشط في البحث والتصنيع. فهو يدخل بنشاط مجموعات السلفوناميد في جزيئات الدواء، مما له تأثير كبير على خصائصها الدوائية.
- تستخدم تفاعلات البلمرة حمض الكلوروسلفوريك بشكل فعال كمحفزات أو بادئات لتخليق البوليمرات الخاصة. تجد هذه البوليمرات تطبيقات نشطة في العديد من الصناعات، مثل الطلاءات والمواد اللاصقة والعزل الكهربائي.
- وهو بمثابة وسيط مهم في إنتاج المواد الكيميائية المختلفة، بما في ذلك أحماض السلفونيك، واسترات حمض الكبريتيك، والكلوروسلفونات. تجد هذه المركبات تطبيقات في صناعات مختلفة مثل الأدوية والكيماويات الزراعية وتصنيع البوليمرات.
- في المختبر، يستخدم الباحثون حمض الكلوروسلفوريك بشكل فعال ككاشف للتفاعلات الكيميائية المختلفة، مثل الأسترة، والأسيلة، وتفاعلات الجفاف.
من المهم التعامل مع حمض الكلوروسلفوريك بحذر بسبب طبيعته المسببة للتآكل والمخاطر الصحية المحتملة.
أسئلة:
س: كيف يمكنني تصنيع كلوريد الأسيتاميدوبنزين سلفونيل من الأسيتانيليد وحمض الكلوروسلفونيك؟
ج: يتم تكوين كلوريد الأسيتاميدوبنزين سلفونيل من خلال معالجة الأسيتانيليد بحمض الكلوروسلفوريك، مما يؤدي إلى استبدال المجموعة الأمينية بمجموعة كلوريد السلفونيل.
س: كيفية استخدام حمض الكلوروسلفونيك؟
ج: يستخدم حمض الكلوروسلفوريك ككاشف في التفاعلات الكيميائية المختلفة، مثل السلفنة والأسترة والأسيلة، لإدخال مجموعات وظيفية أو تعديل الهياكل الجزيئية.
س: هل حمض الكلوروسلفونيك مجموعة مغادرة جيدة؟
ج: نعم يعتبر حمض الكلوروسلفوريك من مجموعة الخروج الجيدة بسبب ثبات مجموعة حمض السلفونيك وقدرته على إجراء تفاعلات الاستبدال.
س: كيفية إزالة حمض الكلوروسلفونيك؟
ج: يجب معادلة حمض الكلوروسلفوريك باستخدام قاعدة، مثل كربونات الصوديوم، ثم تخفيفه بالماء والتخلص منه بعناية وفقًا للوائح المحلية.
س: ماذا يحدث عندما يتلامس حمض الكلوروسلفونيك مع الماء؟
ج: عندما يتلامس حمض الكلوروسلفوريك مع الماء، فإنه يتفاعل بقوة، ويطلق حرارة وغازات سامة، مثل ثاني أكسيد الكبريت وكلوريد الهيدروجين.
س: هل يمكن تحضير كبريتات لوريل الصوديوم عن طريق استبدال حمض الكلوروسلفونيك بكاشف آخر؟
ج: نعم، يمكن تصنيع كبريتات لوريل الصوديوم عن طريق استبدال حمض الكلوروسلفوريك بحمض الكبريتيك في التفاعل مع كحول اللوريل، يليه المعادلة بهيدروكسيد الصوديوم.
س: ما هي كثافة حمض الكلوروسلفونيك؟
ج: تبلغ كثافة حمض الكلوروسلفوريك حوالي 1.75 جم/مل عند درجة حرارة الغرفة.
س: ما عدد مولات حمض الكلوروسلفونيك اللازمة لإنتاج مول واحد من كلوريد أسيتاميدوبنزين سلفونيل؟
ج: يمكن الحصول على مول واحد من كلوريد الأسيتاميدوبنزين سلفونيل عن طريق تفاعل مول واحد من الأسيتانيليد مع مول واحد من حمض الكلوروسلفوريك.
س: هل يمكن تخزين حمض الكلوروسلفونيك مع المواد المؤكسدة؟
ج: لا، يجب تخزين حمض الكلوروسلفوريك بشكل منفصل عن المواد المؤكسدة، لأنه يمكن أن يتفاعل بعنف أو يزيد من خطر نشوب حريق عند ملامسته للمواد المؤكسدة.
