ثنائي إيثيل إيثر أو إيثوكسي إيثان هو سائل عديم اللون وشديد الاشتعال ومتطاير يستخدم عادة كمذيب وكمادة أولية لتخليق المركبات العضوية الأخرى.
| اسم الأيوباك | إيثوكسييثان |
| الصيغة الجزيئية | C4H10O |
| CAS رقم | 60-29-7 |
| المرادفات | إيثر، إيثيل إيثر، أكسيد إيثيل، أكسيد ثنائي إيثيل، 1,1′-أوكسيبيسيثان، إيثر، إيثر مخدر، إيثر كبريتي، إيثيل إيثر |
| إنتشي | إنتشي = 1S/C4H10O/c1-3-5-4-2/h3-4H2.1-2H3 |
خصائص ثنائي إيثيل الأثير
كثافة ثنائي إيثيل إيثر جم/مل
تبلغ كثافة ثنائي إيثيل إيثر 0.713 جم / مل. يتم تعريف الكثافة على أنها كتلة المادة لكل وحدة حجم. وفي حالة ثنائي إيثيل إيثر، تكون كثافته أقل من كثافة الماء الذي تبلغ كثافته 1 جم/مل. وهذا يعني أن ثنائي إيثيل الأثير يطفو على سطح الماء.
الكتلة المولية لثنائي إيثيل إيثر
يحتوي ثنائي إيثيل إيثر على كتلة مولية تبلغ 74.12 جم / مول. الكتلة المولية هي كتلة مول واحد من المادة، معبرًا عنها بالجرام. وفي حالة الإيثوكسي إيثان، يحتوي المول الواحد من المركب على 74.12 جرامًا. هذه القيمة مشتقة من الكتل الذرية للكربون والهيدروجين والأكسجين التي تشكل الجزيء. تعد الكتلة المولية للمادة معلمة مهمة في الحسابات الكيميائية لأنها تستخدم لتحديد كمية المادة الموجودة في عينة معينة.
هيكل ثنائي إيثيل الأثير
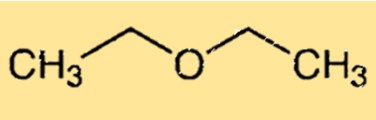
يحتوي ثنائي إيثيل إيثر على بنية كيميائية بسيطة تتكون من مجموعتي إيثيل مرتبطتين بذرة الأكسجين. يمتلك الجزيء شكلًا منحنيًا بسبب وجود زوج وحيد من الإلكترونات على ذرة الأكسجين مما يتسبب في تشويه الجزيء عن الهندسة رباعية السطوح المثالية. يعتبر الهيكل المنحني للإيثوكسي إيثان مسؤولاً عن قدرته على تكوين روابط هيدروجينية مع جزيئات أخرى، مما يجعله مذيبًا مفيدًا.
نقطة غليان ثنائي إيثيل إيثر
نقطة غليان ثنائي إيثيل إيثر هي 34.6 درجة مئوية (94.3 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من حالتها السائلة إلى حالتها الغازية عند الضغط الجوي. يتمتع ثنائي إيثيل إيثر بنقطة غليان منخفضة نسبيًا، مما يجعله سائلًا متطايرًا يتبخر بسهولة في درجة حرارة الغرفة. هذه الخاصية تجعله مفيدًا كمذيب وكمخدر في الطب.
نقطة انصهار ثنائي إيثيل الأثير
نقطة انصهار الإيثوكسي إيثان هي -116.3 درجة مئوية (-177.3 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى الحالة السائلة عند الضغط الجوي. الإيثوكسي إيثان هو سائل عديم اللون في درجة حرارة الغرفة، ومن النادر رؤيته في الحالة الصلبة بسبب نقطة انصهاره المنخفضة.
الوزن الجزيئي لثنائي إيثيل إيثر
يبلغ الوزن الجزيئي لإيثوكسي إيثان 74.12 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. إنها معلمة مهمة في التفاعلات الكيميائية وقياس العناصر الكيميائية لأنها تحدد كمية المادة المتفاعلة اللازمة لتكوين كمية محددة من المنتج.
صيغة ثنائي إيثيل الأثير
الصيغة الكيميائية للإيثوكسي إيثان هي C4H10O. ويتكون من أربع ذرات كربون وعشر ذرات هيدروجين وذرة أكسجين واحدة. تمثل الصيغة العدد الدقيق لكل نوع من الذرات في الجزيء، وتستخدم لتحديد الوزن الجزيئي للمادة. الصيغة الكيميائية للمادة ضرورية في المعادلات الكيميائية، حيث تستخدم لموازنة التفاعلات وتحديد كمية المواد المتفاعلة والمنتجات.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.713 |
| لون | عديم اللون |
| يشم | ناعمة مثل الأثير |
| الكتلة المولية | 74.12 جرام/مول |
| كثافة | 0.713 جم/مل |
| نقطة الانصهار | -116.3 درجة مئوية (-177.3 درجة فهرنهايت) |
| نقطة الغليان | 34.6 درجة مئوية (94.3 درجة فهرنهايت) |
| نقطة فلاش | -45 درجة مئوية (-49 درجة فهرنهايت) |
| الذوبان في الماء | 6.9 جم/لتر عند 25 درجة مئوية |
| الذوبان | قابل للامتزاج في معظم المذيبات العضوية |
| ضغط البخار | 440 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 2.5 |
| pKa | 15.9 |
| الرقم الهيدروجيني | 7 (محايد) |
ثنائي إيثيل الأثير السلامة والمخاطر
يحتوي الإيثوكسي إيثان على العديد من اعتبارات السلامة والمخاطر التي يجب أخذها بعين الاعتبار عند التعامل معها. وهو شديد الاشتعال ويمكن أن يشكل خليطًا من بخار الهواء المتفجر. ولذلك يجب إبعادها عن مصادر الاشتعال والشرر. وقد يسبب أيضًا تهيجًا في الجلد والعينين والجهاز التنفسي، كما أن التعرض له لفترات طويلة قد يسبب الدوخة والصداع. التهوية الكافية ضرورية عند استخدام الإيثوكسي إيثان، ويجب ارتداء معدات الحماية مثل القفازات والنظارات الواقية. ويجب أيضًا تخزينه في مكان بارد وجاف بعيدًا عن العوامل المؤكسدة والمواد غير المتوافقة.
| رموز الخطر | ف، شي |
| وصف الأمان | S9، S16، S29، S33، S60، S61 |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1155 |
| رمز النظام المنسق | 2909.19.00 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثانيا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 3500 ملغم/كغم |
طرق تصنيع ثنائي إيثيل إيثر
توجد طرق مختلفة لتصنيع ثنائي إيثيل إيثر، بما في ذلك تفاعل الإيثانول مع حمض الكبريتيك وتجفيف الإيثانول باستخدام عامل تجفيف مثل حمض الكبريتيك أو الألومينا.
لتصنيع إيثوكسي إيثان عبر طريقة التجفيف، قم بتسخين الإيثانول باستخدام عامل تجفيف مثل حمض الكبريتيك أو الألومينا لإزالة جزيء الماء، وتكوين إيثوكسي إيثان. لتحسين ناتج التفاعل، يمكن استخدام محفز مثل هيدروكسيد البوتاسيوم أو هيدروكسيد الصوديوم.
هناك طريقة أخرى لتصنيع الإيثوكسي إيثان وهي تصنيع إيثر ويليامسون، حيث يتفاعل الإيثانول مع أيون ألكوكسيد مثل إيثوكسيد الصوديوم لتكوين إيثوكسي إيثان. يتطلب هذا التفاعل استخدام قاعدة قوية ومذيب مناسب، مثل الإيثانول اللامائي.
هناك طريقة أخرى لإنتاج الإيثوكسي إيثان وهي استخدام تفاعل تيششينكو. في هذه العملية، يتفاعل حمض الأسيتيك والإيثانول في وجود محفز مثل حمض الكبريتيك أو أكسيد الألومنيوم، مما ينتج عنه إنتاجية عالية من الإيثوكسي إيثان.
لإنتاج إيثوكسي إيثان كمنتج نهائي، يمكن استخدام بوروهيدريد الصوديوم أو ملغم الصوديوم لتقليل الأسيتالديهيد. هذه طريقة أخرى لتركيب الإيثوكسي إيثان. يؤدي هذا التفاعل إلى تكوين الإيثانول ، والذي يمكن أن يخضع بعد ذلك لطريقة التجفيف الموضحة أعلاه لتكوين إيثوكسي إيثان.
استخدامات ثنائي إيثيل إيثر
بعض استخدامات ثنائي إيثيل إيثر تشمل:
- المذيب: مذيب فعال للغاية لمجموعة من المركبات العضوية بما في ذلك الزيوت والدهون والراتنجات والشموع. تستخدم في إنتاج الورنيش والورنيش والطلاءات الأخرى.
- المخدر: يستخدم كمخدر للعمليات الجراحية، على الرغم من أنه تم استبداله إلى حد كبير ببدائل أكثر أماناً في الطب الحديث.
- الاستخلاص: يستخدم كمذيب استخلاص في إنتاج الأدوية والمنتجات الطبيعية والزيوت الأساسية.
- مادة مضافة للوقود: تستخدم كمادة مضافة للوقود لتحسين أداء محركات الديزل، حيث يمكنها زيادة الرقم السيتاني للوقود.
- الوسيط الكيميائي: وسيط رئيسي في إنتاج مجموعة من المركبات العضوية، بما في ذلك الإيثانول والأسيتالديهيد وحمض الأسيتيك.
- عامل النكهة: يستخدم كمادة منكهة في إنتاج بعض الأطعمة والمشروبات، مثل الحلوى والمشروبات الكحولية.
- الكاشف المعملي: يستخدم ككاشف في التجارب المعملية وخاصة في الكيمياء العضوية.
- دافع الأيروسول: يستخدم كوقود دافع في منتجات الأيروسول. أدت المخاوف المتعلقة بالسلامة إلى التخلي التدريجي عن هذا الاستخدام.
أسئلة:
س: هل ثنائي إيثيل الأثير قطبي؟
ج: نعم، الإيثوكسي إيثان هو جزيء قطبي بسبب وجود ذرة الأكسجين، مما يخلق شحنة سالبة جزئية على أحد طرفي الجزيء وشحنة موجبة جزئية على الطرف الآخر.
س: هل ثنائي إيثيل إيثر قابل للامتزاج مع الماء؟
ج: الإيثوكسي إيثان غير قابل للذوبان في الماء. ومع ذلك، فهو يعتبر قابلاً للامتزاج جزئيًا بالماء، مما يعني أنه يمكن أن يمتزج بالماء إلى حد ما ولكن ليس بشكل كامل.
س: هل ثنائي إيثيل إيثر قابل للاشتعال؟
ج: نعم، الإيثوكسي إيثان مادة شديدة الاشتعال ويمكن أن تشكل مخاليط متفجرة مع الهواء.
س: هل ثنائي إيثيل الأثير قطبي أم غير قطبي؟
ج: الإيثوكسي إيثان هو جزيء قطبي بسبب وجود ذرة الأكسجين.
س: هل ثنائي إيثيل الأثير قطبي؟
ج: نعم، يعتبر الإيثوكسي إيثان مذيبًا لابروتيكيًا قطبيًا، مما يعني أنه يمكنه إذابة الجزيئات القطبية ولكنه لا يحتوي على ذرة هيدروجين يمكنها أن تعمل كمانح لرابطة الهيدروجين.
