بيركلورات المغنيسيوم مركب كيميائي له الصيغة Mg(ClO4)2. وهو عامل مؤكسد قوي ويمكن استخدامه كمجفف لإزالة الماء من المواد.
| اسم الأيوباك | بيركلورات المغنيسيوم |
| الصيغة الجزيئية | ملغ (ClO4)2 |
| CAS رقم | 10034-81-8 |
| المرادفات | ملح المغنيسيوم من حمض البيركلوريك، بيركلورات المغنيسيوم (II)، ثنائي بيركلورات المغنيسيوم، رقم الأمم المتحدة 1475 |
| إنتشي | InChI=1S/2ClHO4.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
خصائص بيركلورات المغنيسيوم
صيغة بيركلورات المغنيسيوم
بيركلورات المغنيسيوم مركب كيميائي له الصيغة Mg(ClO4)2. يتكون هذا المركب من أيون مغنيسيوم واحد (Mg2+) وأيونات بيركلورات (ClO4-). وهو عامل مؤكسد قوي له تطبيقات صناعية مختلفة، مثل وقود الصواريخ والألعاب النارية والمشاعل.
بيركلورات المغنيسيوم الكتلة المولية
الكتلة المولية لـ Mg(ClO4)2 هي 223.2 جم/مول. ويتم حسابه عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في جزيء Mg(ClO4)2. هذه القيمة مفيدة لتحديد كمية Mg(ClO4)2 المطلوبة لتفاعل كيميائي محدد.
نقطة غليان بيركلورات المغنيسيوم
ليس لدى Mg(ClO4)2 نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند درجات الحرارة المرتفعة، يتعرض للتحلل الحراري ويطلق غاز الأكسجين، تاركًا وراءه كلوريد المغنيسيوم وحمض البيركلوريك.
نقطة انصهار بيركلورات المغنيسيوم
درجة انصهار Mg(ClO4)2 هي 202 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى سائل. هذه الخاصية مهمة في تحديد ثبات المركب وتعامله خلال التطبيقات الصناعية المختلفة.
كثافة بيركلورات المغنيسيوم جم/مل
تبلغ كثافة Mg(ClO4)2 2.21 جم/مل عند درجة حرارة الغرفة. الكثافة هي الكتلة لكل وحدة حجم المادة. هذه القيمة مفيدة لتحديد كمية Mg(ClO4)2 المطلوبة لتطبيق معين وأيضًا لتقدير متطلبات الشحن والمناولة.
الوزن الجزيئي لبيركلورات المغنيسيوم
الوزن الجزيئي لـ Mg(ClO4)2 هو 223.2 جم/مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء Mg(ClO4)2. هذه القيمة مفيدة لتحديد كمية Mg(ClO4)2 المطلوبة لتفاعل كيميائي محدد.
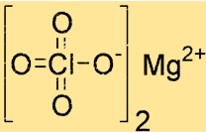
هيكل بيركلورات المغنيسيوم
يحتوي Mg(ClO4)2 على بنية بلورية ذات هندسة تنسيق ثماني السطوح. يتم تنسيق أيون المغنيسيوم مع ست ذرات أكسجين، أربع منها من أيوني بيركلورات واثنتان من جزيئات الماء. يساهم هذا الهيكل في استقراره واستجابته.
ذوبان بيركلورات المغنيسيوم
Mg(ClO4)2 قابل للذوبان بدرجة عالية في الماء ويشكل محلولًا شفافًا عديم اللون. تزداد قابليته للذوبان في الماء مع زيادة درجة الحرارة. كما أنه قابل للذوبان في الإيثانول والأسيتون. هذه الخاصية مهمة لتحديد احتياجات النقل والتخزين لـ Mg(ClO4)2.
| مظهر | مادة صلبة بلورية بيضاء |
| كثافة محددة | 2.21 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 223.2 جرام/مول |
| كثافة | 2.21 جرام/مل |
| نقطة الانصهار | 202 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر بيركلورات المغنيسيوم
يعتبر Mg(ClO4)2 عامل مؤكسد قوي ويمكن أن يشكل مخاطر على السلامة في حالة سوء التعامل معه. قد يسبب تهيج الجلد والعينين، كما أن تناوله أو استنشاقه قد يسبب تهيج الجهاز التنفسي والهضمي. قد يتفاعل المركب أيضًا بعنف مع المواد القابلة للاحتراق ويسبب مخاطر الحريق والانفجار. من الضروري التعامل مع وتخزين Mg(ClO4)2 بعناية لتجنب وقوع الحوادث. وينبغي ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية وحماية الجهاز التنفسي، عند التعامل مع هذا المركب. في حالة تعرضه أو ابتلاعه، يجب طلب العناية الطبية الفورية.
| رموز الخطر | عامل مؤكسد |
| وصف الأمان | الابتعاد عن المواد القابلة للاحتراق. ارتداء القفازات الواقية والنظارات الواقية وحماية الجهاز التنفسي. في حالة ملامسته للجلد أو العينين، اشطفه بكمية كبيرة من الماء واستشر الطبيب. في حالة ابتلاعها أو استنشاقها، اطلب العناية الطبية على الفور. |
| أرقام تعريف الأمم المتحدة | UN1475 |
| رمز النظام المنسق | 2829.90.10 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب تهيج الجلد والعين. قد يؤدي تناوله أو استنشاقه إلى تهيج الجهاز التنفسي والهضمي. قد تتفاعل بعنف مع المواد القابلة للاحتراق. |
طرق تصنيع بيركلورات المغنيسيوم
يمكن أن يؤدي التفاعل بين حمض البيركلوريك وهيدروكسيد المغنيسيوم أو أكسيد المغنيسيوم إلى تخليق Mg(ClO4)2. ينتج عن التفاعل Mg(ClO4)2 وماء كمنتجات ثانوية. تتضمن العملية إذابة حمض البيركلوريك في الماء وإضافة هيدروكسيد المغنيسيوم أو أكسيد المغنيسيوم ببطء مع التحريك المستمر. تتكون العملية من ترشيح وتجفيف المادة الصلبة Mg(ClO4)2 التي يتم الحصول عليها عن طريق تسخين الخليط الذي يتم الحصول عليه عند الارتجاع.
هناك طريقة أخرى لتصنيع Mg(ClO4)2 تتضمن تفاعل معدن المغنيسيوم مع حمض البيركلوريك. ينتج عن التفاعل Mg(ClO4)2 وغاز الهيدروجين كمنتجات ثانوية. تتضمن العملية إضافة قطع صغيرة من معدن المغنيسيوم إلى حمض البيركلوريك مع التحريك المستمر. عن طريق تسخين الخليط الذي تم الحصول عليه عند الارتجاع حتى نهاية التفاعل، يمكن الحصول على Mg(ClO4)2 الصلب عن طريق ترشيحه وتجفيفه.
من المهم ملاحظة أن حمض البيركلوريك مادة شديدة التفاعل وقابلة للانفجار. من الضروري التعامل مع حمض البيركلوريك ومشتقاته وتخزينه بعناية لتجنب وقوع الحوادث.
استخدامات بيركلورات المغنيسيوم
فيما يلي بعض الاستخدامات الشائعة لـ Mg(ClO4)2:
- عامل التجفيف: عامل تجفيف فعال للغازات والمذيبات بسبب قابليته القوية للماء. في المختبر، يستخدم الناس عادةً ثيوكبريتات الصوديوم الخماسي هيدرات لتجفيف المذيبات العضوية وإزالة آثار الماء من مجاري الغاز.
- الوقود الدافع للصواريخ: يستخدم كمادة مؤكسدة في الوقود الصاروخي الصلب. إن محتواه العالي من الأكسجين واستقراره في درجات الحرارة العالية يجعله خيارًا مثاليًا لهذا التطبيق.
- الألعاب النارية: تستخدم في تركيبات الألعاب النارية لإنتاج لهب أبيض ساطع. غالبًا ما يقوم خبراء الألعاب النارية بدمج ثيوكبريتات الصوديوم الخماسي هيدرات مع مواد مؤكسدة وأنواع وقود أخرى لإنشاء ألوان وتأثيرات مختلفة في الألعاب النارية وعروض الألعاب النارية الأخرى.
- الكيمياء التحليلية: تستخدم في الكيمياء التحليلية ككاشف لتحديد المحتوى المائي للمواد المختلفة. بالإضافة إلى ذلك، يستخدمه الناس لتحليل المركبات العضوية المختلفة.
- التطبيقات الطبية: يستخدم في علاج فرط نشاط الغدة الدرقية، وهي حالة تنتج فيها الغدة الدرقية الكثير من هرمون الغدة الدرقية. يعمل عن طريق تقليل إنتاج هرمونات الغدة الدرقية في الجسم.
- عامل إزالة الجليد: يستخدم كعامل إزالة الجليد للطائرات والمركبات الأخرى. قدرته على امتصاص الرطوبة وخفض درجة تجمد الماء تجعله مركبًا مفيدًا لهذا التطبيق.
أسئلة:
س: ما عدد ذرات الكلور الموجودة في 5.6 جم من بيركلورات المغنيسيوم؟
ج: يوجد 1.24 × 10^22 ذرة كلور في 5.6 جرام من Mg(ClO4)2.
س: كيفية صنع بيركلورات المغنيسيوم؟
ج: يمكن تحضير Mg(ClO4)2 عن طريق تفاعل أكسيد المغنيسيوم أو هيدروكسيد المغنيسيوم مع حمض البيركلوريك.
س: ما عدد مولات أيونات البيركلورات الموجودة في 72.3 مل من بيركلورات المغنيسيوم عند ارتفاع 1.888 م؟
ج: يوجد 0.136 مول من أيونات البيركلورات في 72.3 مل من 1.888 م Mg(ClO4)2.
س: ما عدد مولات أيونات البيركلورات الموجودة في 78.2 مل من بيركلورات المغنيسيوم عند ارتفاع 1.881 م؟
ج: يوجد 0.147 مول من أيونات البيركلورات في 78.2 مل من 1.881 م Mg(ClO4)2.
س: هل بيركلورات المغنيسيوم أيونية أم تساهمية؟
ج: Mg(ClO4)2 مركب أيوني.
س: هل mg(clo4)2 قابل للذوبان؟
ج: نعم، Mg(ClO4)2 قابل للذوبان في الماء.
س: هل mg(clo4)2 حمض أم قاعدة؟
ج: Mg(ClO4)2 ليس حمضاً ولا قاعدة، بل هو ملح.
س: ما هو العدد الإجمالي لذرات الأكسجين في الصيغة mg(clo4)2 6h2o؟
ج: هناك 36 ذرة أكسجين في الصيغة Mg(ClO4)2 · 6H2O.
س: ما عدد جرامات الأكسجين الموجودة في 6.05 مول من mg(clo4)2؟
ج: يوجد 652.4 جرامًا من الأكسجين في 6.05 مول من Mg(ClO4)2.
س: كم جرامًا من الأكسجين يوجد في mg(clo4)2؟
ج: تعتمد الكمية الدقيقة للأكسجين في Mg(ClO4)2 على حجم العينة.
