EDTA هو حمض أميني متعدد الكربوكسيل يمكنه خلب أيونات المعادن. له الصيغة [CH2N(CH2CO2H)2]2. يساعد على التخلص من المعادن الثقيلة من الجسم. تقوم EDTA أيضًا بحفظ عينات الدم والمنتجات الغذائية.
| الاسم ايوباك | 2,2′,2″,2″‘-(الإيثان-1,2-ثنائي ثنائي أمونيا) رباعي أسيتات الصوديوم |
| الصيغة الجزيئية | C10H14N2Na2O8 |
| CAS رقم | 139-33-3 |
| المرادفات | ملح ثنائي الصوديوم من حمض رباعي الأسيتيك (إيثيليندينيتريلو)، إيديتات ثنائي الصوديوم، EDTA ثنائي الصوديوم، إيديتات ثنائي الصوديوم، EDTA، ملح ثنائي الصوديوم من EDTA، ملح ثنائي الإيثيلين (حمض إيمينودياسيتيك)، N، N’-1،2- إيثانيديلبيس [N- (كربوكسي ميثيل )جليسين]، ملح ثنائي الصوديوم، Na2-EDTA، Na2H2EDTA |
| إنشي | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
خصائص EDTA
صيغة إدتا
EDTA هو اختصار لحمض الإيثيلين ثنائي أمين رباعي الأسيتيك، وهو مركب عضوي اصطناعي قادر على خلب أيونات المعادن. صيغة EDTA هي C10H16N2O8، مما يعني أنه يحتوي على 10 ذرات كربون و16 ذرة هيدروجين و2 ذرات نيتروجين و8 ذرات أكسجين في جزيئه.
EDTA الكتلة المولية
الكتلة المولية لثنائي الصوديوم إيديتات هي مجموع الكتل الذرية لجميع الذرات الموجودة في صيغته. الكتل الذرية للكربون والهيدروجين والنيتروجين والأكسجين هي 12.01 جم/مول، 1.01 جم/مول، 14.01 جم/مول، و16.00 جم/مول، على التوالي. . ولذلك، فإن الكتلة المولية لثنائي الصوديوم هي (10 × 12.01) + (16 × 1.01) + (2 × 14.01) + (8 × 16.00) = 292.24 جم / مول.
نقطة غليان EDTA
نقطة غليان المادة هي درجة الحرارة التي تتحول عندها من الحالة السائلة إلى الحالة الغازية. ليس من السهل قياس درجة غليان ثنائي الصوديوم، لأنه يتحلل قبل الوصول إلى نقطة الغليان. ومع ذلك، تقدر بعض المصادر درجة غليان ثنائي الصوديوم بحوالي 614.2 درجة مئوية عند ضغط 760 ملم زئبق.
EDTA نقطة الانصهار
نقطة انصهار المادة هي درجة الحرارة التي تتحول عندها من الحالة الصلبة إلى الحالة السائلة. تعتمد نقطة انصهار ثنائي الصوديوم على درجة الماء والتبلور. يحتوي الشكل اللامائي لثنائي الصوديوم الإيديتات على نقطة انصهار تبلغ حوالي 240 درجة مئوية، في حين أن الشكل ثنائي الهيدرات له نقطة انصهار تبلغ حوالي 248 درجة مئوية.
كثافة EDTA جم/مل
كثافة المادة هي الكتلة لكل وحدة حجم. تختلف كثافة ثنائي الصوديوم أيضًا اعتمادًا على درجة الماء والتبلور. تبلغ كثافة الشكل اللامائي من ثنائي الصوديوم إيديتات حوالي 0.86 جم / مل، بينما تبلغ كثافة شكل ثنائي الهيدرات حوالي 1.6 جم / مل.
EDTA الوزن الجزيئي
الوزن الجزيئي للمادة هو مصطلح آخر لكتلتها المولية، وهي كتلة مول واحد من المادة. كما ذكر أعلاه، الكتلة المولية لثنائي الصوديوم إيديتات هي 292.24 جم / مول، لذا فإن وزنه الجزيئي هو أيضًا 292.24 جم / مول.
هيكل EDTA
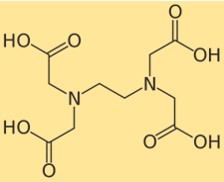
يُظهر هيكل ثنائي الصوديوم إيديتات كيفية ترتيب ذراته وترابطها في جزيئه. يحتوي ثنائي الصوديوم إيديتات على مجموعة إيثيلين ثنائي أمين مركزية مع أربع مجموعات من حمض الكربوكسيل متصلة. يمكن لكل مجموعة حمض كربوكسيلي أن تفقد بروتونًا وتشكل شحنة سالبة يمكن أن ترتبط بأيون فلز. يمكن تمثيل هيكل ثنائي الصوديوم من خلال الرسم البياني التالي:
ذوبان EDTA
قابلية ذوبان المادة هي الكمية التي يمكن أن تذوب في مذيب معين عند درجة حرارة وضغط معينين. تعتمد قابلية ذوبان ثنائي الصوديوم على درجة الحموضة ووجود أيونات معدنية في المحلول. يعد ثنائي الصوديوم Edetate أكثر قابلية للذوبان في المحاليل القلوية منه في المحاليل الحمضية لأنه يشكل شحنات سالبة أكثر يمكن أن تتفاعل مع جزيئات الماء. يمكن أن يشكل ثنائي الصوديوم أيضًا مجمعات تحتوي على أيونات معدنية، والتي يمكن أن تزيد أو تقلل من ذوبانه اعتمادًا على ثبات وشحن المجمع. على سبيل المثال، عند درجة الحموضة 7 و25 درجة مئوية، تبلغ قابلية ذوبان ثنائي الصوديوم في الماء حوالي 0.5 مولار (186 ملغم/مل)، في حين تبلغ قابلية ذوبان مركب الكالسيوم حوالي 0.02 مولار (7 ملغم / مل).
| مظهر | مادة صلبة بلورية بيضاء |
| كثافة محددة | غير متاح |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 292.24 جرام/مول |
| كثافة | 1.6 جم/مل (ثنائي الهيدرات)، 0.86 جم/مل (لا مائي) |
| نقطة الانصهار | 248 درجة مئوية (ثنائي الهيدرات)، 240 درجة مئوية (لا مائي) |
| نقطة الغليان | 614.2 درجة مئوية (تتحلل) |
| نقطة فلاش | 325.2 درجة مئوية |
| الذوبان في الماء | 0.5 م (186 مجم / مل) عند درجة حموضة 7 و 25 درجة مئوية |
| الذوبان | قابل للذوبان في المحاليل القلوية، غير قابل للذوبان في المذيبات العضوية |
| ضغط البخار | 3.77 × 10 ^ -12 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | غير متاح |
| pKa | 2.0، 2.7، 6.2، 10.3 |
| الرقم الهيدروجيني | 4 إلى 6 (محلول 0.26 م) |
مخاطر السلامة من EDTA
إيديتات الصوديوم هو مركب عضوي اصطناعي يمكنه خلب أيونات المعادن. وتتنوع تطبيقاته في مجالات الطب والصناعة والزراعة والأبحاث. ومع ذلك، فإنه يشكل أيضًا بعض المخاطر على صحة الإنسان والبيئة إذا لم يتم التعامل معه بشكل صحيح.
قد يؤدي إيديتات ثنائي الصوديوم إلى تهيج الجلد والعينين إذا لامسهما. وقد يسبب أيضًا الغثيان والقيء والإسهال وآلام البطن في حالة تناوله. قد يضر الجهاز التنفسي في حالة استنشاقه. يمكن أن يؤثر على خلايا الدم والكلى إذا تم امتصاصه في الجسم. يمكن أن تكون قاتلة بجرعات كبيرة.
يمكن أن يؤدي ثنائي الصوديوم أيضًا إلى تلويث التربة والمياه إذا تم إطلاقه في البيئة. يمكن أن يرتبط بالمعادن الأساسية ويؤثر على توفرها للنباتات والحيوانات. يمكن أن تتداخل مع العمليات البيولوجية التي تعتمد على أيونات المعادن.
استخدم ثنائي الصوديوم بحذر ومع معدات الحماية المناسبة. قم بتخزينه في مكان بارد وجاف وجيد التهوية. تخلص منه وفقًا للوائح المحلية.
| رموز الخطر | |
| وصف الأمان | S24/25: تجنب ملامسة الجلد والعينين |
| أرقام تعريف الأمم المتحدة | UN3077 (صلب)، UN3082 (سائل) |
| رمز النظام المنسق | 29224985 |
| فئة الخطر | 9 (مواد خطرة مختلفة) |
| مجموعة التعبئة | III (خطر منخفض) |
| تسمم | الجرذ LD50 عن طريق الفم: 2000 ملغم/كغم |
طرق تركيب EDTA
هناك عدة طرق لتصنيع ثنائي الصوديوم، ولكن الأكثر شيوعًا هو تكثيف الإيثيلينديامين مع حمض الكلوروسيتيك أو ملح الصوديوم الخاص به.
يشتمل التفاعل على خطوتين: أولاً، يشكل هجوم الإيثيلينديامين المحب للنواة على حمض الكلوروسيتيك أو ملح الصوديوم الخاص به مادة وسيطة أحادية الأميد. ثانيا، إزالة حمض الهيدروكلوريك أو كلوريد الصوديوم يشكل مجموعة حمض الكربوكسيلية. لتكوين إيديتات ثنائي الصوديوم، يمكن تفاعله مع مكافئ آخر لحمض الكلوروسيتيك أو ملح الصوديوم الخاص به.
طريقة أخرى لتصنيع ثنائي الصوديوم هي أكسدة الإيثيلينديامين مع هيبوكلوريت الصوديوم في محلول قلوي. تنتج هذه الطريقة ثنائي الصوديوم إيديتات كملح صوديوم والأمونيا كمنتج ثانوي.
تتضمن الطرق الأخرى لتصنيع إيديتات ثنائي الصوديوم تفاعل الإيثيلينديامين مع الفورمالديهايد وسيانيد الصوديوم أو تفاعل الإيثيلينديامين مع حمض الجلايوكسيليك أو استراته.
استخدامات EDTA
إيديتات الصوديوم هو مركب عضوي اصطناعي يمكنه خلب أيونات المعادن. ولها استخدامات مختلفة في مختلف المجالات والصناعات. بعض استخدامات Edetate Disodium هي:
- في الطب، يمكن لثنائي الصوديوم إيديتات علاج التسمم بالمعادن الثقيلة عن طريق الارتباط بالمعادن السامة وإزالتها من الجسم. ويمكنه أيضًا منع جلطات الدم وتكلس الشرايين عن طريق خلب أيونات الكالسيوم.
- في الأطعمة والمشروبات، يمكن لثنائي الصوديوم إيديتات الحفاظ على لون ونكهة وملمس المنتجات عن طريق منع الأكسدة والتزنخ. ويمكنه أيضًا منع تغير اللون والتدهور الناجم عن الأيونات المعدنية.
- في مستحضرات التجميل والعناية الشخصية، يمكن لثنائي الصوديوم إيديتات تحسين استقرار وفعالية المنتجات عن طريق منع نمو الميكروبات والتفاعلات المحفزة بالمعادن. ويمكنه أيضًا تحسين شكل وملمس المنتجات عن طريق خلب المعادن المسؤولة عن عسر الماء.
- في الصناعة والأبحاث، يمكن لثنائي الصوديوم إيديتات تحسين أداء وجودة المنتجات والعمليات عن طريق خلب أيونات المعادن المتداخلة. على سبيل المثال، يمكن أن يمنع تكوين القشور في الغلايات والأنابيب، ويحسن صباغة وطباعة المنسوجات، ويزيل الصدأ والبقع من المعادن، ويتحكم في درجة الحموضة وتركيز المعادن في الطرق التحليلية.
أسئلة:
س: ما هو EDTA؟
ج: ثنائي الصوديوم إيديتات هو مركب عضوي اصطناعي يمكنه خلب أيونات المعادن. إنه يرمز إلى حمض الإيثيلين ثنائي أمين رباعي الأسيتيك.
س: كيفية تحضير محلول EDTA؟
ج: لتحضير محلول ثنائي الصوديوم الإيديتات، قم بوزن الكمية المطلوبة من ثنائي الصوديوم الإيديتات وقم بإذابته في الماء المقطر. اضبط الرقم الهيدروجيني إلى 8.0 باستخدام هيدروكسيد الصوديوم.
س: كيف تذوب EDTA في الماء؟
ج: ثنائي الصوديوم إيديتات قابل للذوبان في الماء، لكنه يذوب ببطء. لإذابة ثنائي الصوديوم الإيديتات في الماء، قم بتسخين الماء إلى حوالي 80 درجة مئوية وحرك الخليط حتى يذوب ثنائي الصوديوم الإيديتات تمامًا.
س: كيفية تحضير 0.5M EDTA؟
ج: لتحضير 0.5 م من ثنائي الصوديوم الإيديتات، قم بوزن 73.06 جم من ثنائي الصوديوم الإيديتات وقم بإذابته في 800 مل من الماء المقطر. اضبط الرقم الهيدروجيني إلى 8.0 باستخدام هيدروكسيد الصوديوم وقم بتخفيف المحلول إلى 1 لتر بالماء المقطر.
س: ماذا تفعل EDTA؟
ج: يرتبط ثنائي الصوديوم بأيونات المعادن ويشكل معها معقدات مستقرة. وهذا يمنع أيونات المعادن من التفاعل مع المواد الأخرى أو التدخل في الطرق التحليلية.
س: ماذا يعني EDTA؟
ج: إيديتات ثنائي الصوديوم تعني حمض إيثيلين ثنائي أمين رباعي أسيتيك، وهو اسم المركب بالصيغة [CH2N(CH2CO2H)2]2.
س: كيف يتم حساب عسر الماء عن طريق المعايرة بـ EDTA؟
ج: لحساب صلابة المياه عن طريق معايرة ثنائي الصوديوم، قم بمعايرة حجم معروف من عينة الماء بمحلول ثنائي الصوديوم القياسي باستخدام مؤشر مناسب. سجل حجم ثنائي الصوديوم المستخدم واستخدم الصيغة التالية: الصلابة (ملجم/لتر مثل CaCO3) = (حجم EDTA x مولارية EDTA x 1000) / حجم عينة الماء
