أكسيد الحديد الثالث هو مركب يتكون من مزيج كيميائي من الحديد والأكسجين. ويسمى عادة الصدأ وله لون بني محمر.
| اسم الأيوباك | أكسيد الحديد (III). |
| الصيغة الجزيئية | Fe2O3 |
| CAS رقم | 1309-37-1 |
| المرادفات | أكسيد الحديديك، الهيماتيت، أكسيد الحديد، الصدأ |
| إنتشي | إن تشي = 1S/2Fe.3O |
خصائص أكسيد الحديد الثالث
صيغة أكسيد الحديد الثالث
صيغة أكسيد الحديد III هي Fe2O3. وهذا يعني أن كل جزيء Fe2O3 يحتوي على ذرتين حديد وثلاث ذرات أكسجين. تمثل هذه الصيغة الكيميائية نسبة العناصر الموجودة في المركب.
الكتلة المولية لأكسيد الحديد الثالث
يمكن حساب الكتلة المولية لـ Fe2O3 عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يحتوي الحديد على كتلة ذرية تبلغ 55.845 جم / مول، بينما تبلغ الكتلة الذرية للأكسجين 16.00 جم / مول. وبالتالي فإن الكتلة المولية لـ Fe2O3 تبلغ حوالي 159.69 جم / مول.
نقطة غليان أكسيد الحديد III
ليس لدى Fe2O3 نقطة غليان مميزة لأنه يخضع للتحلل عند التسخين. ومع ذلك، فإنه يبدأ في التحلل عند حوالي 1565 درجة مئوية (2849 درجة فهرنهايت). عند درجات الحرارة المرتفعة، يتحلل Fe2O3 إلى الحديد والأكسجين.
نقطة انصهار أكسيد الحديد الثالث
يحتوي Fe2O3 على نقطة انصهار عالية نسبيًا. يذوب عند حوالي 1565 درجة مئوية (2849 درجة فهرنهايت). درجة الحرارة هذه أعلى من نقطة انصهار الحديد المعدني، والتي تبلغ حوالي 1538 درجة مئوية (2800 درجة فهرنهايت). يؤدي تسخين Fe2O3 إلى ذوبانه وتحوله إلى حالة سائلة.
كثافة أكسيد الحديد III جم/مل
تبلغ كثافة Fe2O3 حوالي 5.24 جم / مل. وهو مركب صلب ذو كثافة عالية نسبيا، مما يدل على أنه أثقل من حجم مساو من الماء. كثافة المادة هي مقياس لكتلتها لكل وحدة حجم.
الوزن الجزيئي لأكسيد الحديد الثالث
يتم حساب الوزن الجزيئي لـ Fe2O3 عن طريق إضافة الأوزان الذرية للذرات المكونة له. نظرًا لأن Fe2O3 يحتوي على ذرتي حديد وثلاث ذرات أكسجين، فيمكن حساب الوزن الجزيئي على النحو التالي (2 × 55.845 جم / مول) + (3 × 16.00 جم / مول) = 159.69 جم / مول.
هيكل أكسيد الحديد الثالث
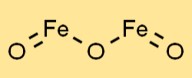
يحتوي Fe2O3 على بنية شبكية بلورية. وهي تشكل شبكة من ذرات الحديد والأكسجين المرتبطة بروابط أيونية قوية. ترتيب الذرات في الشبكة يؤدي إلى ظهور خواصها الفيزيائية، مثل الصلابة والهشاشة.
ذوبان أكسيد الحديد الثالث
Fe2O3 غير قابل للذوبان في الماء وفي معظم المذيبات العضوية. لا يذوب أو ينفصل بسهولة إلى أيونات عند ملامسته لهذه المواد. ومع ذلك، فإنه يمكن أن يتفاعل مع الأحماض القوية لتكوين أملاح الحديد والماء. ذوبان Fe2O3 محدود في المذيبات المختلفة.
| مظهر | بني محمر صلب |
| جاذبية معينة | 5.24 جم/مل |
| لون | بني محمر |
| يشم | عديم الرائحة |
| الكتلة المولية | 159.69 جرام/مول |
| كثافة | 5.24 جم/مل |
| نقطة الانصهار | 1,565 درجة مئوية (2,849 درجة فهرنهايت) |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | غير قابل للذوبان في الماء ومعظم المذيبات الأخرى |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | حيادي |
السلامة ومخاطر أكسيد الحديد الثالث
لا يشكل Fe2O3 مخاطر صحية كبيرة في ظل الظروف العادية. ومع ذلك، فمن الضروري التعامل معها بعناية. يجب تجنب استنشاق جزيئات Fe2O3 الدقيقة لأن ذلك قد يؤدي إلى تهيج الجهاز التنفسي. الاتصال المباشر بالعينين أو الجلد قد يسبب تهيجًا طفيفًا. عند العمل مع Fe2O3، فمن المستحسن ارتداء معدات الحماية الشخصية المناسبة، بما في ذلك القفازات ونظارات السلامة، لتجنب التهيج المحتمل للجلد أو العينين. في حالة الابتلاع العرضي أو التعرض لفترة طويلة، يوصى باستشارة الطبيب. ومن المهم أيضًا اتباع إرشادات التخزين والتخلص المناسبة لتجنب التلوث البيئي.
| رموز الخطر | لا أحد |
| وصف الأمان | – تجنب استنشاق جزيئات الغبار \n- ارتدي معدات الحماية المناسبة \n- تعامل بحذر |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2821.10.00 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة للبشر عند التعامل معها بشكل صحيح |
طرق تخليق أكسيد الحديد III
هناك عدة طرق لتجميع Fe2O3. الطريقة الشائعة هي أكسدة الحديد في وجود الأكسجين. يمكن أن يتفاعل الحديد مع الأكسجين الموجود في الغلاف الجوي، خاصة في وجود الرطوبة، ليشكل طبقة من Fe2O3، والتي يطلق عليها عادة الصدأ. تحدث هذه العملية بشكل طبيعي مع مرور الوقت على الأسطح الحديدية المكشوفة.
تتضمن الطريقة الأخرى التحلل الحراري لهيدروكسيد الحديد (III) أو نترات الحديد (III). تسخين هيدروكسيد الحديد (III) يطلق الماء والأكسجين، ويشكل Fe2O3. وبالمثل، يؤدي تسخين نترات الحديد (III) أيضًا إلى تحلل المركب، مكونًا Fe2O3 بالإضافة إلى ثاني أكسيد النيتروجين والأكسجين كمنتجات ثانوية.
يمكن استخدام تفاعلات الترسيب لتخليق Fe2O3. تتضمن هذه الطريقة خلط أملاح الحديد، مثل كبريتات الحديد (II) أو كلوريد الحديد (III) ، مع محلول قلوي، مثل هيدروكسيد الصوديوم أو هيدروكسيد الأمونيوم . مزيد من التسخين أو الأكسدة للراسب، هيدروكسيد الحديد III، ينتج Fe2O3.
تتيح التقنيات المختلفة، مثل طرق السول-جل، والتوليف الحراري المائي، وتقنيات الترسيب المشترك، تخليق جسيمات Fe2O3 النانوية. تتضمن هذه الطرق غالبًا ترسيبًا متحكمًا فيه أو تكوين جسيمات نانوية من سلائف الحديد في وجود عوامل تثبيت مناسبة أو مواد خافضة للتوتر السطحي.
من المهم ملاحظة أن طريقة التوليف المحددة التي تم اختيارها تعتمد على الخصائص المطلوبة وتطبيق منتج Fe2O3. ولكل طريقة مزاياها واعتباراتها من حيث التكلفة وقابلية التوسع والنقاء والتحكم في حجم الجسيمات.
استخدامات أكسيد الحديد الثالث
يجد Fe2O3 العديد من التطبيقات بسبب خصائصه المميزة. بعض استخداماته الشائعة تشمل:
- الصباغ: تستخدم الدهانات والطلاءات والملونات Fe2O3 على نطاق واسع كصبغة، مما يضفي لونًا بنيًا محمرًا مرغوبًا على مواد مختلفة.
- عامل التلميع: تستخدم عمليات التشطيب المعدني Fe2O3 كعامل تلميع لتنعيم وتحسين مظهر الأسطح المعدنية.
- المحفز: يعمل Fe2O3 كمحفز في التفاعلات الكيميائية، مثل إنتاج الأمونيا أو تفاعل تحويل الماء والغاز.
- المادة المغناطيسية: يستخدم المصنعون Fe2O3 في إنتاج وسائط التسجيل المغناطيسية، مثل الأشرطة والأقراص، وذلك بسبب خصائصها المغناطيسية.
- الكاشف الكيميائي: تستخدم التجارب المعملية المختلفة Fe2O3 ككاشف كيميائي، خاصة في تفاعلات الأكسدة والاختزال وتخليق المركبات الأخرى.
- التحفيز الضوئي: تُظهر تطبيقات التحفيز الضوئي، مثل معالجة مياه الصرف الصحي وتحويل الطاقة الشمسية، إمكانات الجسيمات النانوية Fe2O3.
- صبغة السيراميك: في صناعة السيراميك، يعمل Fe2O3 كصبغة للزجاج، مما يضيف اللون والجاذبية البصرية لمنتجات السيراميك.
- مادة مضافة للخرسانة: Fe2O3 هي مادة مضافة للخرسانة تعمل على تحسين قوتها ومتانتها ومظهرها الجمالي للهياكل الخرسانية.
- مادة القطب الكهربائي: تستخدم بعض أنواع البطاريات، مثل بطاريات الليثيوم أيون، Fe2O3 كمادة قطب كهربائي.
- التطبيقات الصيدلانية: يقوم الباحثون باستكشاف جسيمات Fe2O3 النانوية في أنظمة توصيل الأدوية وتطبيقات التصوير في الطب.
هذه مجرد أمثلة قليلة على التطبيقات المختلفة لـ Fe2O3، مما يدل على تعدد استخداماته في مختلف الصناعات.
أسئلة:
س: ما هي صيغة أكسيد الحديد (III)؟
ج: صيغة أكسيد الحديد (III) هي Fe2O3.
س: ما عدد مولات الحديد الموجودة في 4 مولات من أكسيد الحديد (III)؟
ج: في 4 مولات من Fe2O3 يوجد 8 مولات من الحديد.
س: ما كتلة O2 اللازمة لأكسدة الحديد إلى أكسيد الحديد (III)؟
ج: لأكسدة الحديد إلى Fe2O3، يلزم وجود 3 مولات من O2 مقابل 4 مولات من الحديد.
س: ما عدد الذرات الموجودة في أكسيد الحديد (III)؟
ج: يوجد في جزيء Fe2O3 5 ذرات.
س: ما كتلة الحديد الموجودة في 35.0 جم من الصدأ (أكسيد الحديديك أو أكسيد الحديد (III))؟
ج: كتلة الحديد في 35.0 جم من الصدأ (Fe2O3) تساوي 23.3 جم تقريبًا.
س: لماذا يتكون الصدأ على شكل أكسيد الحديد (III) وليس أكسيد الحديد (II)؟
ج: يتشكل الصدأ على شكل Fe2O3 لأن أكسيد الحديد (II) يتفاعل بسهولة مع الأكسجين الموجود في الهواء، مما يزيد من الأكسدة ليشكل Fe2O3.
س: ما هي قيمة الرقم الهيدروجيني التي تتوقع أن تكون لأكسيد الحديد (III)؟
ج: Fe2O3 غير قابل للذوبان في الماء وليس حمضيًا ولا قاعديًا، لذلك ليس له تأثير كبير على الرقم الهيدروجيني.
س: ما هي كثافة أكسيد الحديد (III)؟
ج: تبلغ كثافة Fe2O3 حوالي 5.24 جم/مل.
س: ما عدد الذرات الموجودة في جزيء أكسيد الحديد (Fe2O3)؟
ج: يوجد 5 ذرات في جزيء أكسيد الحديد (Fe2O3).
س: ما هو Fe2O3؟
ج: Fe2O3 هي الصيغة الكيميائية لأكسيد الحديد (III)، المعروف أيضًا باسم الصدأ.
س: ما عدد الجزيئات الموجودة في 79 جم من Fe2O3؟
ج: يوجد ما يقرب من 4.08 × 10^23 جزيء في 79 جم من Fe2O3.
س: كيفية تحقيق التوازن بين Fe2O3 + C = Fe + CO2؟
ج: المعادلة المتوازنة هي 2Fe2O3 + 3C = 4Fe + 3CO2.
س: ما العنصر الذي يتأكسد في هذا التفاعل؟ Fe2O3 + 3CO → 2Fe + 3CO2.
أ: يتأكسد الكربون (C) في هذا التفاعل.
س: هل Fe2O3 أيوني أم تساهمي؟
ج: Fe2O3 مركب أيوني.
س: ما المادة المؤكسدة في هذا التفاعل؟ Fe2O3 + 3CO → 2Fe + 3CO2.
ج: Fe2O3 هو العامل المؤكسد في هذا التفاعل.
س: ما هو اسم Fe2O3؟
ج: اسم Fe2O3 هو أكسيد الحديديك أو الصدأ.
