الأسيتاميد مادة صلبة بلورية بيضاء ذات رائحة طفيفة. يتم تصنيعه عن طريق تفاعل حمض الأسيتيك مع الأمونيا. ويستخدم عادة في صناعة المواد البلاستيكية والأدوية.
| اسم الأيوباك | إيثاناميد |
| الصيغة الجزيئية | C2H5NO |
| CAS رقم | 60-35-5 |
| المرادفات | أميد حمض الأسيتيك، إثاميد، إيثاناميد، CH3CONH2 |
| إنتشي | InChI=1S/C2H5NO/c1-2(3)4/h1H3,(H2,3,4) |
خصائص الأسيتاميد
الأسيتاميد الكتلة المولية
يمتلك الأسيتاميد كتلة مولية تبلغ 59.07 جم/مول، وهو مجموع الكتل الذرية لجميع الذرات الموجودة في جزيء الأسيتاميد. تفيد الكتلة المولية للمركب في تحديد عدد مولات المركب الموجود في عينة معينة. كما أنها تستخدم لحساب نسبة كتلة المركب.
درجة غليان الأسيتاميد
درجة غليان الإيثاناميد هي 222 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها الإيثاناميد من سائل إلى غاز. تتأثر نقطة غليان المادة بقوة القوى الجزيئية، والإيثاناميد لديه روابط هيدروجينية قوية بين جزيئاته. ولذلك، فهو يتمتع بنقطة غليان عالية نسبيًا مقارنة بالأميدات الأخرى.
نقطة انصهار الأسيتاميد
نقطة انصهار الإيثاناميد هي 82.5 درجة مئوية. هذه هي درجة الحرارة التي يتغير عندها الإيثاناميد من الحالة الصلبة إلى الحالة السائلة. تتأثر نقطة انصهار المادة بقوة القوى الجزيئية، وفي حالة الإيثاناميد توجد روابط هيدروجينية قوية بين جزيئاتها. ولذلك فإن درجة انصهاره مرتفعة نسبياً مقارنة بالأميدات الأخرى.
كثافة الأسيتاميد جم/مل
كثافة الإيثاناميد 1.16 جم / مل. الكثافة هي كتلة المادة لكل وحدة حجم وهي خاصية فيزيائية مفيدة لتحديد وتوصيف المواد. الأسيتاميد مركب كثيف نسبيًا ويمكن استخدام كثافته في العمليات الحسابية لتطبيقات مختلفة.
الوزن الجزيئي للأسيتاميد
الوزن الجزيئي للأسيتاميد هو 59.07 جم / مول. هذه القيمة مفيدة لتحديد كمية الأسيتاميد الموجودة في العينة، وكذلك لحسابات العناصر المتكافئة في التفاعلات الكيميائية.
هيكل الأسيتاميد
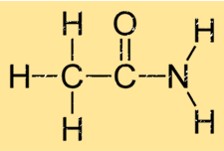
يمتلك الأسيتاميد بنية بسيطة تتكون من مجموعة كربونيل (C=O) مرتبطة بمجموعة أمينية (NH2). وهذا يعطيها الصيغة الجزيئية C2H5NO. ترتبط مجموعتي الكربونيل والأمينية بذرة كربون واحدة. يسمح هيكل الإيثاناميد بتكوين روابط هيدروجينية قوية مع جزيئات الإيثاناميد الأخرى، مما يساهم في خواصه الفيزيائية مثل نقطة الغليان ونقطة الانصهار.
صيغة الأسيتاميد
الصيغة الكيميائية للإيثاناميد هي CH3CONH2، مما يدل على أنه يحتوي على ذرة كربون واحدة، وذرتين هيدروجين، وذرة نيتروجين واحدة، وذرة أكسجين واحدة. تفيد الصيغة في تحديد العناصر ونسبها الموجودة في المركب. ومن المفيد أيضًا تحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تتضمن الإيثاناميد.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.16 جم/مل |
| لون | عديم اللون |
| يشم | رائحة طفيفة |
| الكتلة المولية | 59.07 جرام/مول |
| كثافة | 1.16 جم/مل |
| نقطة الانصهار | 82.5 درجة مئوية |
| نقطة الغليان | 222 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | امتزاج تماما |
| الذوبان | قابل للذوبان في الإيثانول والأثير والبنزين والكلوروفورم |
| ضغط البخار | 0.000138 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 2.1 |
| pKa | 16.5 |
| الرقم الهيدروجيني | 6.5 – 7.5 (10% محلول مائي) |
سلامة ومخاطر الأسيتاميد
يعتبر الأسيتاميد مركبًا آمنًا نسبيًا، لكنه لا يزال يشكل بعض المخاطر. قد يسبب تهيج الجلد والعينين والجهاز التنفسي عند التعرض له لفترة طويلة. قد يسبب أيضًا تهيج الجهاز الهضمي واكتئاب الجهاز العصبي المركزي في حالة تناوله. الأسيتاميد قابل للاشتعال وقد يسبب حرائق إذا تعرض للحرارة أو اللهب. من المهم التعامل مع الإيثاناميد بعناية واستخدام معدات الحماية، مثل القفازات ونظارات السلامة، عند العمل معه. تعتبر التهوية والتخزين المناسبين ضرورية أيضًا لتجنب التعرض غير الضروري وتقليل المخاطر المحتملة.
| رموز الخطر | لا أحد |
| وصف الأمان | تجنب التعرض لفترات طويلة. ارتداء معدات الحماية. من الضروري توفير التهوية والتخزين المناسبين. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 29242990 |
| فئة الخطر | غير مصنفة على أنها خطرة من قبل OSHA أو GHS |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 3.8 جم/كجم؛ التركيز المميت للنصف (الاستنشاق، الفئران): أكبر من 20 ملغم/لتر (التعرض لمدة 4 ساعات) |
طرق تصنيع الأسيتاميد
يمكن أن تتفاعل الأمونيا أو أملاح الأمونيوم مع حمض الأسيتيك لتصنيع الإيثاناميد، ويمكن أن تتفاعل الأمونيا مع كلوريد الأسيتيل لتصنيع الإيثاناميد، ويمكن أن تخضع خلات الأمونيوم للجفاف لتصنيع الإيثاناميد.
في الطريقة الأولى، يحفز أكسيد الزنك أو النحاس تفاعل حمض الأسيتيك والأمونيا أو أملاح الأمونيوم لتصنيع الإيثاناميد. ينتج عن التفاعل الإيثاناميد والماء كمنتجات ثانوية.
في الطريقة الثانية، تتفاعل قاعدة مثل هيدروكسيد الصوديوم أو غاز الأمونيا مع كلوريد الأسيتيل لإنتاج الإيثاناميد. ينتج عن التفاعل غاز الإيثاناميد وكلوريد الهيدروجين كمنتجات ثانوية.
في الطريقة الثالثة، يقوم عامل التجفيف مثل حمض الكبريتيك بتسهيل تجفيف خلات الأمونيوم لتصنيع الإيثاناميد والماء كمنتج ثانوي.
استخدامات الأسيتاميد
للأسيتامايد العديد من الاستخدامات في صناعات مختلفة نظرًا لخصائصه الفريدة. بعض الاستخدامات الشائعة للإيثاناميد هي:
- المذيب: غالبًا ما يستخدمه المصنعون كمذيب لإنتاج البلاستيك والألياف والراتنجات.
- صناعة الأدوية: يستخدم في صناعة الأدوية كمادة خام لتخليق الأدوية المختلفة وأيضاً كمثبت لبعض المضادات الحيوية.
- صناعة النسيج: يستخدم في صناعة النسيج كملين للألياف الصناعية مثل النايلون وكعامل صباغة للقطن والألياف الطبيعية الأخرى.
- الصناعة الكيميائية: تستخدم أيضًا كمادة كيميائية وسيطة في إنتاج المواد الكيميائية المختلفة مثل الأكريلونيتريل وأنهيدريد الأسيتيك والأكريلاميد.
- صناعة المواد الغذائية: يستخدم كمنكه ومكون في بعض المنتجات الغذائية مثل المخبوزات والحلويات والآيس كريم.
- الأبحاث المخبرية: يستخدم في الأبحاث المخبرية كمذيب وكاشف وأيضاً كمزيل للبروتينات.
أسئلة:
س: ما هو الكاشف أو تسلسل الكواشف الذي سيحول الأسيتاميد إلى أسيتات الإيثيل؟
ج: يمكن تحويل الأسيتاميد إلى أسيتات الإيثيل عن طريق تفاعله مع كلوروفورمات الإيثيل في وجود قاعدة مثل البيريدين. ينتج عن التفاعل خلات الإيثيل وثاني أكسيد الكربون وغاز كلوريد الهيدروجين كمنتجات ثانوية.
س: هل الأسيتاميد حمض أميني؟
ج: لا، الإيثاناميد ليس حمضًا أمينيًا. وهو مشتق من حمض الأسيتيك ويحتوي على مجموعة أميد وظيفية (-CONH2) بدلاً من مجموعة أمينية (-NH2).
س: ما هو ناتج تفاعل الأسيتاميد مع H2O-؟
ج: يؤدي تفاعل الأسيتاميد مع H2O- (أيون الهيدروكسيد) إلى التحلل المائي للأسيتاميد لتكوين حمض الأسيتيك والأمونيا.
س: كيف يمكنني إزالة مذيب الأسيتاميد من البلورات؟
ج: لإزالة مذيب الإيثاناميد من البلورات، يمكن استخدام تقنيات مثل إعادة البلورة أو الترشيح الفراغي. تتضمن عملية إعادة البلورة إذابة البلورات في مذيب مناسب، مثل الماء، ثم السماح للمذيب بالتبخر ببطء للحصول على بلورات نقية. يتضمن الترشيح الفراغي تصفية البلورات من خلال ورق الترشيح تحت ضغط منخفض لإزالة أي مذيب إيثاناميد متبقي.
س: هل يحتوي الأسيتاميد على رابطة هيدروجينية؟
ج: نعم، يمكن للإيثاناميد أن يشارك في الرابطة الهيدروجينية بسبب وجود متقبل الرابطة الهيدروجينية (-CO) والمتبرع بالرابطة الهيدروجينية (-NH2) في بنيته الجزيئية.
