أكسيد النحاس (I) هو مسحوق أحمر أو بني، له الصيغة الكيميائية Cu2O. يتم استخدامه كصبغة ومحفز وفي الخلايا الشمسية لخصائصه شبه الموصلة.
| اسم الأيوباك | أكسيد النحاس (I). |
| الصيغة الجزيئية | Cu2O |
| CAS رقم | 1317-39-1 |
| المرادفات | أكسيد النحاس، كوبرايت، أكسيد النحاس، ديلافوسيت، أول أكسيد النحاس، تحت أكسيد النحاس |
| إنتشي | InChI = 1S/2Cu.O |
الكتلة المولية Cu2O
الكتلة المولية لـ Cu2O هي 143.09 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية لذرتي نحاس (63.55 جم/مول × 2) وذرة أكسجين واحدة (15.99 جم/مول). الكتلة المولية هي خاصية مهمة للمركب الكيميائي تساعد في تحديد كمية المادة الموجودة في عينة معينة. كما أنه يستخدم في الحسابات المتكافئة لتحديد كمية المواد المتفاعلة اللازمة للتفاعل الكيميائي.
نقطة غليان Cu2O
ليس لدى Cu2O نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند تسخينه، فإنه يتحلل إلى النحاس المعدني وغاز الأكسجين. تبلغ درجة حرارة تحلل Cu2O حوالي 900 درجة مئوية. لذلك، يتم استخدام Cu2O بشكل رئيسي كمادة صلبة، مثل الصباغ أو أشباه الموصلات.
نقطة انصهار Cu2O
نقطة انصهار Cu2O هي 1232 درجة مئوية. هذه القيمة أعلى من معظم المعادن وأكاسيد المعادن. يتمتع Cu2O بنقطة انصهار عالية بسبب الرابطة الأيونية القوية بين ذرات النحاس والأكسجين. نقطة الانصهار العالية تجعل Cu2O مفيدًا في تطبيقات درجات الحرارة المرتفعة، مثل طلاء السيراميك والمواد المقاومة للحرارة.
كثافة Cu2O جم/مل
كثافة Cu2O هي 6.01 جم/سم3. وهذه القيمة أعلى من كثافة معدن النحاس (8.96 جم/سم3) لوجود ذرات الأكسجين. الكثافة العالية لـ Cu2O تجعله مفيدًا في العديد من التطبيقات، مثل صناعة الموصلات الكهربائية وأشباه الموصلات.
الوزن الجزيئي لـ Cu2O
الوزن الجزيئي لـ Cu2O هو 143.09 جم / مول. يتم حساب هذه القيمة عن طريق جمع الأوزان الذرية لذرتي نحاس وذرة أكسجين واحدة. يعد الوزن الجزيئي لـ Cu2O معلمة مهمة لتحديد الخواص الفيزيائية والكيميائية للمركب. كما أنه يستخدم في الحسابات المتكافئة لتحديد كمية المواد المتفاعلة اللازمة للتفاعل الكيميائي.
هيكل Cu2O
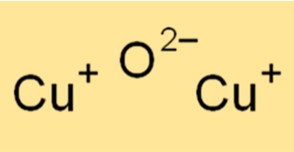
يحتوي Cu2O على بنية بلورية مكعبة. يشبه التركيب البلوري لـ Cu2O هيكل الملح الصخري (NaCl). تتكون الشبكة البلورية Cu2O من ذرات النحاس المنسقة مع ذرات الأكسجين بنسبة 1:1. التركيب البلوري لـ Cu2O يجعله مادة مفيدة في تطبيقات مختلفة، مثل صناعة أشباه الموصلات والمحفزات.
صيغة أكسيد النحاس (I).
الصيغة الكيميائية لأكسيد النحاس (I) هي Cu2O. تنص الصيغة على أن أكسيد النحاس (I) يتكون من ذرتين نحاس وذرة أكسجين واحدة. تُستخدم صيغة أكسيد النحاس (I) لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تتضمن أكسيد النحاس (I). كما أنها تستخدم لحساب الكتلة المولية والوزن الجزيئي للمركب. الصيغة الكيميائية لأكسيد النحاس (I) مهمة في تحديد خصائصه الفيزيائية والكيميائية، مثل اللون، ونقطة الانصهار، والكثافة.
| مظهر | مسحوق أحمر أو بني |
| جاذبية معينة | 6.01 جم/سم3 |
| لون | أحمر أو بني |
| يشم | عديم الرائحة |
| الكتلة المولية | 143.09 جرام/مول |
| كثافة | 6.01 جم/سم3 |
| نقطة الانصهار | 1232 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | قابل للذوبان في الأحماض المركزة وهيدروكسيد الأمونيوم |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| PKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | 8.0 – 9.0 (10% معلق في الماء) |
سلامة ومخاطر أكسيد النحاس (I).
يعتبر Cu2O آمنًا نسبيًا في التعامل معه، ولكن يجب التعامل معه بحذر نظرًا لمخاطره المحتملة. وهو مهيج للعيون والجلد والجهاز التنفسي. الاتصال المباشر مع مسحوق Cu2O قد يسبب تهيج الجلد، في حين أن استنشاق المسحوق قد يسبب تهيج الجهاز التنفسي. كما أنها مادة صلبة قابلة للاشتعال وقد تشتعل إذا تعرضت للحرارة أو اللهب. يمكن أن يتفاعل Cu2O بعنف مع مواد معينة، مثل الأحماض والهالوجينات، ويطلق غازات سامة. وينبغي اتخاذ الاحتياطات الكافية عند التعامل مع Cu2O، مثل ارتداء الملابس الواقية وتجنب الاتصال بالمواد غير المتوافقة.
| رموز الخطر | Xn: ضار |
| وصف الأمان | S22: لا تتنفس الغبار. S36/37/39: ارتد الملابس الواقية المناسبة والقفازات وأدوات حماية العين/الوجه. S46: في حالة ابتلاعه، اطلب المشورة الطبية فورًا وأظهر هذه الحاوية أو الملصق. |
| معرفات | UN3077 |
| رمز النظام المنسق | 28255000 |
| فئة الخطر | 9- المواد الخطرة المتنوعة |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة، ولكن قد تسبب تهيج العينين والجلد والجهاز التنفسي عن طريق الاتصال المباشر أو الاستنشاق. |
طرق تصنيع أكسيد النحاس (I).
هناك طرق مختلفة لتصنيع أكسيد النحاس (I) (Cu2O)، بما في ذلك الأكسدة الحرارية، والترسيب، والترسيب الكهروكيميائي، والاختزال الكيميائي.
تتضمن الأكسدة الحرارية تسخين معدن النحاس إلى درجات حرارة عالية في وجود الأكسجين أو الهواء لتكوين Cu2O. يمكن تنفيذ العملية في الفرن أو عن طريق أكسدة اللهب.
يتضمن الترسيب تفاعل أملاح النحاس مع محلول قلوي، مثل هيدروكسيد الصوديوم، لتكوين رواسب Cu2O. يمكن ترشيح الرواسب وغسلها وتجفيفها للحصول على مسحوق Cu2O.
يتضمن الترسيب الكهروكيميائي التحليل الكهربائي لمحلول ملح النحاس باستخدام قطب كهربائي خامل لترسيب Cu2O على سطح القطب.
يتضمن الاختزال الكيميائي اختزال أيونات النحاس باستخدام عامل اختزال، مثل بوروهيدريد الصوديوم أو الهيدرازين، في وجود عامل تثبيت، مثل البولي فينيل بيروليدون.
تتضمن الطريقة الأخرى التحلل الحراري لفورمات النحاس في وجود عامل اختزال، مثل اليوريا، لتكوين Cu2O.
كل طريقة توليف لها مزاياها وعيوبها من حيث الإنتاجية والنقاء وقابلية التوسع. من المهم اختيار الطريقة المناسبة بعناية استنادًا إلى التطبيق المقصود والخصائص المطلوبة لـ Cu2O.
استخدامات أكسيد النحاس (I).
لدى أكسيد النحاس (I) مجموعة واسعة من التطبيقات بسبب خصائصه الفريدة، بما في ذلك سلوك أشباه الموصلات، والنشاط التحفيزي، والخصائص المضادة للبكتيريا. بعض الاستخدامات الشائعة لـ Cu2O تشمل:
- الإلكترونيات: تستخدم كمادة شبه موصلة من النوع P في الأجهزة الإلكترونية مثل الخلايا الشمسية والكاشفات الضوئية والترانزستورات ذات التأثير الميداني.
- المحفز: يستخدم كمحفز في التفاعلات الكيميائية المختلفة، مثل أكسدة أول أكسيد الكربون واختزال أكاسيد النيتروجين.
- الصباغ: يستخدم كصبغة حمراء في السيراميك والزجاج والمينا.
- مبيد الفطريات: يستخدم كمبيد فطري لمكافحة أمراض النبات مثل اللفحة والبياض الزغبي والصدأ.
- عامل مضاد للحشف على السفن: يستخدم كعامل مضاد للحشف في الدهانات البحرية لمنع نمو الكائنات البحرية على السفن والمنشآت البحرية.
- عامل مضاد للجراثيم: له خصائص مضادة للجراثيم. تستخدم في التطبيقات الطبية مثل الضمادات والطلاءات المضادة للبكتيريا.
- المادة المضافة: تستخدم كمادة مضافة في علف الحيوانات لمنع نقص النحاس في الماشية.
يوضح تنوع تطبيقات Cu2O إمكاناته كمواد قيمة في مختلف الصناعات.
أسئلة:
س: هل أكسيد النحاس (I) خطير عندما يجف؟
ج: لا يعتبر Cu2O خطيرًا عندما يكون جافًا، ولكنه يمكن أن يكون مهيجًا للجهاز التنفسي عند استنشاقه في شكل مسحوق.
س: هل أكسيد النحاس (I) مركب طبيعي؟
ج: نعم، Cu2O هو مركب طبيعي موجود في بعض المعادن، مثل الكوبريت والتينوريت.
س: ما الذي يذيب أكسيد النحاس (I)؟
ج: Cu2O غير قابل للذوبان في الماء وفي معظم المذيبات العضوية. ويمكن إذابته في الأحماض القوية، مثل حمض الهيدروكلوريك، وفي محاليل الأمونيا أو سيانيد البوتاسيوم.
س: ما هي الطريقة الكيميائية لتكوين طبقة أكسيد النحاس (I) على النحاس المعدني؟
ج: تتضمن الطريقة الكيميائية لتكوين طبقة من Cu2O على النحاس المعدني غمر النحاس في محلول من كبريتات النحاس وكلوريد الصوديوم، ثم تسخين النحاس في الهواء لأكسدة السطح.
س: كيف يمكن استخلاص النحاس من أكسيد النحاس (I)؟
ج: يمكن استخلاص النحاس من Cu2O عن طريق تسخين المركب بالكربون أو عامل اختزال آخر لاختزال Cu2O إلى نحاس معدني.
س: ما عدد مولات النحاس اللازمة لتكوين مول واحد من Cu2O؟
ج: نحتاج إلى 2 مول من النحاس لتكوين 1 مول من Cu2O.
س: ما هو Cu2O؟
ج: Cu2O هي الصيغة الكيميائية لأكسيد النحاس (I)، وهو مسحوق أحمر أو بني محمر وهو أكسيد النحاس.
س: ماذا يحدث عند وجود أكسيد النحاس (I) على سطح النحاس؟
ج: عندما يكون أكسيد النحاس (I) موجودًا على سطح النحاس، فإنه يمكن أن يعمل كطبقة واقية ضد المزيد من الأكسدة والتآكل لمعدن النحاس.
