الكلور (Cl2) هو غاز أصفر مخضر شديد التفاعل. يتم استخدامه في معالجة المياه، كمطهر وفي إنتاج المواد الكيميائية المختلفة، مثل PVC والمذيبات.
| اسم الأيوباك | ديكلور |
| الصيغة الجزيئية | Cl2 |
| CAS رقم | 7782-50-5 |
| المرادفات | الكلور الجزيئي، الكلور، كلورو، كلور، كلور، كلوريتو دي كلورو |
| إنتشي | إنشي = 1S/Cl2/c1-2 |
Cl2 الكتلة المولية
الكتلة المولية لـ Cl2، أو الكلور، هي مجموع الكتل الذرية لذرتين من ذرات الكلور، أو 70.906 جم/مول. من المهم معرفة الكتلة المولية لـ Cl2 عند حساب كمية المادة اللازمة للتفاعل الكيميائي أو عند التحويل بين وحدات القياس المختلفة.
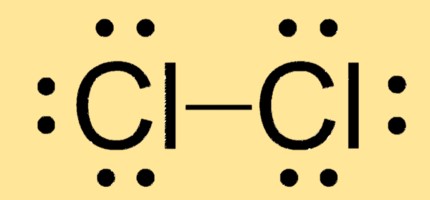
هيكل لويس Cl2
يحتوي Cl2 على هندسة جزيئية خطية تحتوي على ذرتين من الكلور مرتبطتين برابطة تساهمية واحدة. يتكون هيكل لويس من ذرتين Cl لكل منهما ثلاثة أزواج وحيدة وزوج إلكترون واحد مشترك بينهما.
نقطة الغليان Cl2
نقطة غليان Cl2 هي -34.04 درجة مئوية (-29.27 درجة فهرنهايت) عند الضغط القياسي. وهذه نقطة غليان منخفضة نسبيًا، والتي تنتج غاز Cl2 عند درجة حرارة الغرفة والضغط. من المهم توخي الحذر عند التعامل مع Cl2، لأنه يمكن أن يتحول بسهولة إلى سائل أو صلب عند درجات الحرارة والضغط المنخفض.
نقطة انصهار Cl2
نقطة انصهار Cl2 هي -101.5 درجة مئوية (-150.7 درجة فهرنهايت) عند الضغط القياسي. وهذه نقطة انصهار منخفضة نسبيًا، والتي تنتج غاز Cl2 عند درجة حرارة الغرفة والضغط. من المهم توخي الحذر عند التعامل مع Cl2، لأنه يمكن أن يتحول بسهولة إلى سائل أو صلب عند درجات الحرارة والضغط المنخفض.
كثافة Cl2 جم/مل
تبلغ كثافة Cl2 0.003214 جم / مل عند درجة الحرارة والضغط القياسيين (STP). وهذا يعني أن Cl2 أقل كثافة بكثير من الهواء وسوف يرتفع إلى الغلاف الجوي. يمكن تخزين Cl2 في أسطوانات مضغوطة أو في خزانات تحتوي على غازات أثقل من الهواء مثل النيتروجين.
الوزن الجزيئي للكلور
الوزن الجزيئي لـ Cl2 هو 70.906 جم / مول. هذه هي كتلة مول واحد من Cl2، الذي يحتوي على عدد أفوجادرو من الجزيئات (6.022 × 10 ^ 23). الوزن الجزيئي لـ Cl2 مهم للحسابات المتكافئة في الكيمياء.
هيكل الكلور
هيكل Cl2 خطي، حيث ترتبط ذرتان من الكلور معًا بواسطة رابطة تساهمية. طول الرابطة بين ذرتي الكلور هو 1.99 أنجستروم وطاقة الرابطة هي 242 كيلوجول/مول. التكوين الإلكتروني لـ Cl2 هو [Ne] 3s23p5، حيث تساهم كل ذرة كلور بإلكترون واحد في زوج الرابطة.
صيغة الكلور
صيغة Cl2 هي ببساطة ذرتان Cl مرتبطتان معًا. يتم تمثيل ذلك بواسطة Cl-Cl أو Cl2. الصيغة مهمة لتحديد تكوين مركب أو جزيء ولحسابات العناصر المتكافئة في الكيمياء.
| مظهر | غاز أصفر مخضر |
| جاذبية معينة | 1.56 (سائل) |
| لون | اصفر مائل للخضرة |
| يشم | رائحة نفاذة وخانقة |
| الكتلة المولية | 70.906 جم/مول |
| كثافة | 0.003214 جم/مل في STP |
| نقطة الانصهار | -101.5 درجة مئوية (-150.7 درجة فهرنهايت) |
| نقطة الغليان | -34.04 درجة مئوية (-29.27 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | 0.92 جم / 100 مل عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الماء والإيثانول والأثير والبنزين والعديد من المذيبات العضوية |
| ضغط البخار | 102.44 كيلو باسكال عند 20 درجة مئوية |
| كثافة بخار | 2.49 (الهواء = 1) |
| pKa | – |
| الرقم الهيدروجيني | – |
Cl2 السلامة والمخاطر
الكلور هو غاز شديد التفاعل يمكن أن يشكل مخاطر خطيرة على السلامة والصحة إذا لم يتم التعامل معه بشكل صحيح. يمكن أن يسبب تهيجًا خطيرًا في الجهاز التنفسي وتلفًا للعينين والجلد والأغشية المخاطية. استنشاق تركيزات عالية من الكلور يمكن أن يسبب الوذمة الرئوية، والتي يمكن أن تهدد الحياة. كما أن الكلور مادة أكالة للغاية ويمكن أن تلحق الضرر بالمعادن والبلاستيك والمواد الأخرى. ولضمان التعامل الآمن مع الكلور، يجب ارتداء معدات الحماية الشخصية المناسبة، مثل النظارات الواقية والقفازات وجهاز التنفس الصناعي. يجب استخدام الكلور فقط في المناطق جيدة التهوية ويجب وضع ملصقات على جميع الحاويات بشكل صحيح وتخزينها في مكان آمن.
| رموز الخطر | جمجمة وعظمتين متقاطعتين |
| وصف الأمان | غاز شديد السمية والتآكل؛ يسبب تهيجًا شديدًا في الجهاز التنفسي والجلد. يمكن أن تكون قاتلة إذا تم استنشاقها بتركيزات عالية |
| أرقام تعريف الأمم المتحدة | UN1017 |
| رمز النظام المنسق | 2801.1 |
| فئة الخطر | 2.3 |
| مجموعة التعبئة | أنا |
| تسمم | سام جدا؛ استنشاق تركيزات عالية يمكن أن يسبب وذمة رئوية وتكون قاتلة |
طرق تخليق الكلور
هناك طرق مختلفة لتصنيع غاز الكلور، بما في ذلك التحليل الكهربائي للمحلول الملحي، وأكسدة حمض الهيدروكلوريك، والتحلل الحراري لكلوريدات المعادن.
الطريقة الأكثر شيوعًا هي التحليل الكهربائي للمحلول الملحي، والذي يتضمن تمرير تيار كهربائي عبر محلول كلوريد الصوديوم (NaCl) والماء (H2O). تولد هذه العملية غاز الكلور عند الأنود وغاز الهيدروجين عند الكاثود.
طريقة أخرى لإنتاج الكلور هي أكسدة حمض الهيدروكلوريك مع عامل مؤكسد، مثل KMnO4 أو MnO2. ينتج عن هذا التفاعل غاز الكلور والماء كمنتجات ثانوية.
يعد التحلل الحراري لكلوريدات المعادن، مثل MgCl2 أو FeCl3، طريقة أخرى لتوليد غاز الكلور. تتضمن هذه العملية تسخين كلوريد المعدن إلى درجة حرارة عالية، مما يؤدي إلى تحلله وإطلاق غاز الكلور.
بشكل عام، تعتمد طريقة التصنيع المستخدمة للكلور على التطبيق المحدد والنقاء المطلوب للغاز. بغض النظر عن الطريقة المستخدمة، من المهم التعامل مع الكلور بحذر نظرًا لطبيعته شديدة التفاعل والسامة.
استخدامات الكلور
لغاز الكلور مجموعة واسعة من الاستخدامات في مختلف الصناعات. أحد الاستخدامات الرئيسية للكلور هو إنتاج كلوريد البوليفينيل (PVC)، وهي مادة بلاستيكية تستخدم على نطاق واسع. ويستخدم الكلور أيضًا في إنتاج مركبات الكلور الأخرى، مثل الكلوروفورم ورابع كلوريد الكربون، والتي تستخدم كمذيبات وفي صناعة مواد التبريد.
في صناعة معالجة المياه، يستخدم الكلور بشكل شائع كمطهر لمعالجة مياه الشرب ومياه الصرف الصحي. غاز الكلور فعال في قتل البكتيريا والفيروسات، ويمكنه أيضًا أكسدة وإزالة المركبات العضوية والملوثات الأخرى من الماء.
وفي صناعة اللب والورق، يُستخدم غاز الكلور كعامل تبييض لتبييض المنتجات الورقية. كما أنه يستخدم في إنتاج المنسوجات، مثل النايلون والبوليستر، وكذلك في صناعة الأصباغ والأصباغ.
ولغاز الكلور أيضًا تطبيقات أخرى، لا سيما في إنتاج بعض المنتجات الصيدلانية وفي الصناعة المعدنية لتجريد الأسطح المعدنية وتنظيفها. ومع ذلك، نظرًا لطبيعته الخطرة، يجب التعامل مع الكلور بحذر ويجب اتخاذ احتياطات السلامة المناسبة أثناء تخزينه ونقله واستخدامه.
أسئلة:
س: هل Cl2 قطبي أم غير قطبي؟
ج: Cl2 هو جزيء غير قطبي.
س: هل الكلور معدن؟
ج: لا، الكلور ليس معدنًا. وهو هالوجين وينتمي إلى مجموعة العناصر غير المعدنية.
س: ما هو المعدن اللين الذي يتحد مع الكلور لينتج ملح الطعام؟
ج: الصوديوم (Na) هو المعدن الناعم الذي يتحد مع الكلور (Cl) لينتج ملح الطعام (NaCl).
س: كيفية كلورة الماء؟
ج: تتم كلورة الماء عمومًا عن طريق إضافة كمية محسوبة من غاز الكلور أو هيبوكلوريت الصوديوم أو هيبوكلوريت الكالسيوم إلى إمدادات المياه. تعتمد كمية الكلور المضافة على نوعية المياه ومستوى التطهير المطلوب. يتفاعل الكلور مع البكتيريا والكائنات الحية الدقيقة الأخرى الموجودة في الماء، مما يؤدي إلى قتلها بشكل فعال وجعل المياه صالحة للشرب.
س: أي مما يلي يعالج بالكلور للحصول على مسحوق التبييض؟
ج: تتم معالجة أكسيد الكالسيوم (CaO) بالكلور (Cl2) للحصول على مسحوق التبييض (CaOCl2).
