هيدروكسيد الحديد (III) هو مركب يتكون من تفاعل الحديد مع الماء. ويشيع استخدامه في المستحضرات الصيدلانية، وفي معالجة المياه وكصبغة في الدهانات.
| اسم الأيوباك | هيدروكسيد الحديد (III). |
| الصيغة الجزيئية | الحديد (أوه) ₃ |
| CAS رقم | 20344-49-4 |
| المرادفات | هيدروكسيد الحديديك، ثلاثي هيدروكسيد الحديد، هيدرات الحديديك، أوكسي هيدروكسيد الحديد (III). |
| إنتشي | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
خواص هيدروكسيد الحديد (III).
صيغة هيدروكسيد الحديد (III).
صيغة هيدروكسيد الحديد (III) هي Fe(OH)₃. يشير هذا إلى أن كل جزيء Fe(OH)₃ يتكون من ذرة Fe واحدة مرتبطة بثلاثة أيونات OH.
الحديد (III) هيدروكسيد الكتلة المولية
يمكن حساب الكتلة المولية لـ Fe(OH)₃ عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يمتلك الحديد كتلة مولية قدرها 55.845 جم/مول، ولكل أيون هيدروكسيد (OH) كتلة مولية قدرها 17.007 جم/مول. ولذلك، فإن الكتلة المولية لـ Fe(OH)₃ تساوي تقريبًا 106.867 جم/مول.
نقطة غليان هيدروكسيد الحديد (III).
ليس لدى Fe(OH)₃ نقطة غليان محددة جيدًا لأنه يتحلل قبل الوصول إلى نقطة الغليان. وبدلاً من ذلك، فإنه يخضع للتحلل الحراري لتكوين أكسيد الحديد (III) والماء عند تسخينه.
نقطة انصهار هيدروكسيد الحديد (III).
يتحلل Fe(OH)₃ أيضًا عند التسخين وليس له نقطة انصهار مميزة. ويتحول إلى أكسيد الحديد (III) والماء عند درجات حرارة عالية.
كثافة هيدروكسيد الحديد (III) جم/مل
تعتمد كثافة Fe(OH)₃ على عوامل مختلفة مثل حالته الفيزيائية (صلبة أو محلول) وتركيزه. تبلغ كثافة الشكل الصلب من Fe(OH)₃ حوالي 3.4 جم/مل.
الحديد (III) الوزن الجزيئي لهيدروكسيد
يتم حساب الوزن الجزيئي لـ Fe(OH)₃ عن طريق إضافة الأوزان الذرية للذرات المكونة له. يبلغ الوزن الجزيئي لـ Fe(OH)₃ حوالي 106.867 جم/مول.
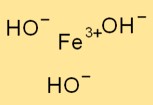
هيكل هيدروكسيد الحديد (III).
يتخذ Fe(OH)₃ بنية مثلثية، حيث تكون ذرة الحديد محاطة بثلاثة أيونات هيدروكسيد. تعمل ذرة الحديد كذرة مركزية وترتبط بها أيونات الهيدروكسيد بروابط أيونية.
ذوبان هيدروكسيد الحديد (III).
Fe(OH)₃ له قابلية ذوبان محدودة في الماء. وهو يشكل راسباً عندما يذوب في الماء وتعتمد ذوبانه على عوامل مختلفة مثل درجة الحرارة ودرجة الحموضة ووجود أيونات أخرى. تزداد قابلية ذوبان Fe(OH)₃ في الظروف الحمضية.
| مظهر | بني صلب |
| جاذبية معينة | 3.4 |
| لون | بني |
| يشم | عديم الرائحة |
| الكتلة المولية | 106,867 جرام/مول |
| كثافة | 3.4 جرام/مل |
| نقطة الانصهار | متحللة |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | لا يتحلل في الماء. يعتمد على عوامل مثل درجة الحرارة ودرجة الحموضة ووجود أيونات أخرى |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | حوالي 5-7 |
سلامة ومخاطر هيدروكسيد الحديد (III).
يطرح Fe(OH)₃ بعض الاعتبارات والمخاطر المتعلقة بالسلامة. ويعتبر عموما أن تكون ذات سمية منخفضة. ومع ذلك، فإن تناول أو استنشاق كميات كبيرة قد يسبب تهيج الجهاز الهضمي وعدم الراحة في الجهاز التنفسي. من المهم تجنب ملامسة العينين والجلد، لأن ذلك قد يسبب تهيجًا. في حالة ملامسته، اشطف المناطق المصابة بكمية كبيرة من الماء. عند التعامل مع Fe(OH)₃، يُنصح بارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، لتقليل مخاطر التعرض. ويجب التأكد من التهوية الكافية لتجنب تراكم الغبار. بالإضافة إلى ذلك، من الضروري اتباع احتياطات السلامة والتعامل مع Fe(OH)₃ بحذر لتقليل المخاطر المحتملة.
| رموز الخطر | لا أحد |
| وصف الأمان | – تجنب ملامسة العينين والجلد <br> – ارتداء معدات الحماية <br> – التأكد من التهوية الكافية |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2821.10.0000 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة |
طرق تصنيع هيدروكسيد الحديد (III).
هناك طرق مختلفة لتجميع Fe(OH)₃. تتضمن الطريقة شائعة الاستخدام تفاعل الترسيب بين ملح الحديد والقاعدة. على سبيل المثال، عن طريق إضافة محلول كلوريد الحديد (FeCl₃) إلى محلول هيدروكسيد الصوديوم (NaOH) ، يمكن تشكيل Fe(OH)₃. يحدث التفاعل على النحو التالي:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
في طريقة أخرى، يمكن أكسدة هيدروكسيد الحديد (II) إلى Fe(OH)₃ عن طريق تعريضه للهواء أو معالجته بعامل مؤكسد. يحدث التفاعل على النحو التالي:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
بالإضافة إلى ذلك، يمكن تحضير Fe(OH)₃ عن طريق التحلل المائي لمحلول ملح الحديد. تتضمن هذه العملية إضافة الماء إلى محلول ملح الحديد، مما يؤدي إلى تكوين راسب Fe(OH)₃. يحدث التفاعل على النحو التالي:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
توفر طرق التوليف هذه طرقًا للحصول على Fe(OH)₃ لتطبيقات مختلفة، بما في ذلك المستحضرات الصيدلانية ومعالجة المياه وكصبغة في الدهانات. من المهم اتباع احتياطات السلامة المناسبة والتعامل مع المواد الكيميائية بطريقة مسؤولة أثناء عملية التوليف.
استخدامات هيدروكسيد الحديد (III).
لدى Fe(OH)₃ العديد من التطبيقات نظرًا لخصائصه الفريدة. فيما يلي بعض الاستخدامات الشائعة لـ Fe(OH)₃:
- صناعة الأدوية: تستخدم صناعة الأدوية Fe(OH)₃ في إنتاج مكملات الحديد والأدوية، مثل تلك المستخدمة لعلاج فقر الدم الناجم عن نقص الحديد.
- معالجة المياه: تستخدم عمليات معالجة المياه Fe(OH)₃ لإزالة الملوثات والشوائب. يعمل Fe(OH)₃ كمندد، مما يساعد على تكتل وإزالة الجزيئات العالقة في الماء.
- الصباغ في الدهانات: Fe(OH)₃، ذو اللون البني، يُستخدم كصبغة في الدهانات والطلاءات والأصباغ. إنه يضفي مجموعة من الألوان الترابية وهو مفيد بشكل خاص لإنتاج ألوان مغرة وسيينا.
- معالجة مياه الصرف الصحي: تستخدم محطات معالجة مياه الصرف الصحي Fe(OH)₃ لإزالة الفوسفات والملوثات المعدنية الثقيلة من مياه الصرف الصناعي.
- التحفيز: يعمل Fe(OH)₃ كمحفز في التفاعلات الكيميائية المختلفة، بما في ذلك تحلل بيروكسيد الهيدروجين وتفاعلات الأكسدة.
- الممتز: يعمل Fe(OH)₃ كمادة ماصة لإزالة الشوائب والملوثات والأصباغ من المحاليل.
- تعديل التربة: يعمل Fe(OH)₃ كتعديل للتربة لتحسين خصوبة التربة وتوافر العناصر الغذائية. فهو يحسن قدرة التربة على الاحتفاظ بالمغذيات ويوفر الحديد الضروري لنمو النبات.
- كاشف المختبر: في المختبر، يستخدم الباحثون والمحللون Fe(OH)₃ ككاشف لمجموعة متنوعة من الأغراض التحليلية والبحثية، بما في ذلك تفاعلات الترسيب وتعديل الرقم الهيدروجيني.
تسلط التطبيقات المتنوعة لـ Fe(OH)₃ الضوء على أهميته في الصناعات المختلفة ومساهمته في عمليات مختلفة تتراوح من الأدوية إلى الصرف الصحي البيئي.
أسئلة:
س: ما هو الوزن الصحيح لصيغة هيدروكسيد الحديد (III)؟
ج: الوزن الصحيح للصيغة Fe(OH)₃ هو حوالي 106.867 جم/مول.
س: ما المعادلة الأيونية الكاملة للتفاعل بين FeBr3 وهيدروكسيد الباريوم؟
ج: المعادلة الأيونية الكاملة للتفاعل بين FeBr3 وهيدروكسيد الباريوم هي FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
س: ما كتلة راسب هيدروكسيد الحديد (III) التي يمكن إنتاجها من تفاعل 75.0 مل؟
ج: لتحديد كتلة راسب Fe(OH)₃، من الضروري الحصول على معلومات إضافية مثل تركيز المواد المتفاعلة أو مولاريتها.
س: كيف يتم تكوين هيدروكسيد الحديد (III)؟
ج: يمكن تكوين Fe(OH)₃ بعدة طرق، بما في ذلك تفاعلات الترسيب بين أملاح الحديد وقواعده، أو أكسدة Fe(OH)2، أو التحلل المائي لمحلول ملح الحديد.
س: هل هيدروكسيد الحديد (III) قابل للذوبان؟
ج: لا، Fe(OH)₃ غير قابل للذوبان في الماء. يشكل راسباً عند إذابته في الماء.
س: ما عدد جرامات Fe(OH)₃ الموجودة في 4.61 جرام من Fe³⁺؟
ج: لتحديد جرامات Fe(OH)₃، من الضروري وجود الكتلة المولية لـ Fe³⁺ وقياس العناصر المتفاعلة للتفاعل.
س: ما هو لون Fe(OH)₃؟
ج: Fe(OH)₃ لونه بني بشكل عام.
س: هل هيدروكسيد الحديد مادة صلبة؟
ج: نعم، يوجد هيدروكسيد الحديد في الحالة الصلبة.
س: ماذا ينتج هيدروكسيد الحديد المتحلل حراريا؟
ج: ينتج Fe(OH)₃ المتحلل حراريًا أكسيد الحديد (III) (Fe₂O₃) والماء.
س: هل هيدروكسيد الحديد يذوب في الماء؟
ج: لا، هيدروكسيد الحديد لا يذوب في الماء. يشكل راسباً عند مزجه بالماء.
