الهيدرازين أو N2H4 هو مركب عديم اللون وشديد التفاعل يتكون من النيتروجين والهيدروجين. يتم استخدامه كوقود صاروخي، في الأدوية والمواد الكيميائية الزراعية، وكعامل اختزال في التفاعلات الكيميائية.
| اسم الأيوباك | الهيدرازين |
| الصيغة الجزيئية | N2H4 |
| CAS رقم | 302-01-2 |
| المرادفات | ديامين. ديازان. هيدريد النيتروجين. هيدرازين لا مائي؛ هيدرازين لا مائي؛ هيدروكسيد الهيدرازينيوم. هيدرازين رطب. ميثيل هيدرازين. هيدرازين متماثل |
| إنتشي | إنشي=1S/H4N2/c1-2/h2H,1H2 |
هيكل لويس N2H4:
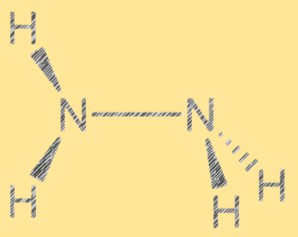
يوضح هيكل لويس للهيدرازين ترتيب الإلكترونات في الجزيء. ويتكون الهيكل من ذرتين من النيتروجين، تحتوي كل منهما على زوج من الإلكترونات الحرة، وأربع ذرات هيدروجين. ترتبط ذرتي النيتروجين برابطة تساهمية واحدة وترتبط كل ذرة نيتروجين أيضًا بذرتي هيدروجين. يساعد هيكل لويس للهيدرازين في تفسير تفاعله وخصائصه.
اسم المركب N2H4 :
اسم المركب N2H4 هو الهيدرازين. يأتي الاسم من حقيقة أن الهيدرازين مركب يحتوي على ذرات الهيدروجين والنيتروجين. يُعرف الهيدرازين أيضًا بأسماء أخرى مختلفة، بما في ذلك الديامين والديازان وهيدريد النيتروجين.
الكتلة المولية N2H4:
الكتلة المولية للهيدرازين، مع الصيغة الجزيئية N2H4، هي 32.04 جم / مول. وهو مركب خفيف نسبيا يتكون من ذرتين نيتروجين وأربع ذرات هيدروجين. تعد الكتلة المولية المنخفضة للهيدرازين أحد أسباب استخدامه بشكل شائع كوقود للصواريخ، حيث يوفر نسبة عالية من الدفع إلى الوزن.
نقطة غليان الهيدرازين:
الهيدرازين لديه نقطة غليان تبلغ 113.5 درجة مئوية (236.3 درجة فهرنهايت) عند الضغط الجوي. تعني نقطة الغليان المنخفضة أن الهيدرازين يمكن أن يتبخر بسهولة، مما قد يجعل التعامل معه خطيرًا. عند تسخينه، يمكن أن يتحلل الهيدرازين إلى غاز النيتروجين وغاز الهيدروجين، مما قد يجعله خطيرًا أيضًا.
نقطة انصهار الهيدرازين:
نقطة انصهار الهيدرازين هي -51.7 درجة مئوية (-61.06 درجة فهرنهايت). وهذا يعني أن الهيدرازين سائل في درجة حرارة الغرفة والضغط. نقطة انصهاره المنخفضة تعني أيضًا أنه يمكن أن يتصلب بسهولة في درجات حرارة باردة، مما قد يجعل من الصعب التعامل معه.
كثافة الهيدرازين جم/مل:
تبلغ كثافة الهيدرازين 1.00 جم / مل عند درجة حرارة الغرفة والضغط. وهذا يعني أن الهيدرازين أكثر كثافة قليلاً من الماء، الذي تبلغ كثافته 1.00 جم/مل تحت نفس الظروف.
الوزن الجزيئي للهيدرازين:
الوزن الجزيئي للهيدرازين هو 32.04 جم / مول. تُستخدم هذه القيمة لحساب كمية الهيدرازين اللازمة في التفاعلات الكيميائية والتطبيقات الأخرى.
هيكل الهيدرازين:
يتكون هيكل الهيدرازين من ذرتين نيتروجين مرتبطتين ببعضهما البعض بواسطة رابطة تساهمية واحدة، مع ربط كل ذرة نيتروجين أيضًا بذرتي هيدروجين. وهذا يعطي الهيدرازين بنية جزيئية متناظرة على شكل حرف V. يلعب هيكل الهيدرازين دورًا مهمًا في تفاعله وخصائصه.
صيغة الهيدرازين:
الصيغة الكيميائية للهيدرازين هي N2H4. تشير هذه الصيغة إلى أن الهيدرازين يتكون من ذرتين نيتروجين وأربع ذرات هيدروجين. تُستخدم الصيغة لتمثيل الهيدرازين في المعادلات والتفاعلات الكيميائية.
| مظهر | عديم اللون إلى سائل أصفر شاحب |
| جاذبية معينة | 1.00 جم/مل |
| لون | عديم اللون |
| يشم | رائحة الأمونيا |
| الكتلة المولية | 32.04 جم/مول |
| كثافة | 1.00 جم/مل |
| نقطة الانصهار | -51.7 درجة مئوية (-61.06 درجة فهرنهايت) |
| نقطة الغليان | 113.5 درجة مئوية (236.3 درجة فهرنهايت) |
| نقطة فلاش | 38 درجة مئوية (100 درجة فهرنهايت) |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في الإيثانول، ثنائي إيثيل الأثير، والكلوروفورم |
| ضغط البخار | 72 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 1.0 (الهواء=1) |
| pKa | 8 |
| الرقم الهيدروجيني | الأساسية (الرقم الهيدروجيني > 7) |
سلامة ومخاطر الهيدرازين
الهيدرازين مركب شديد التفاعل وخطير ويتطلب معالجة وتخزينًا دقيقًا. وهو سام ويمكن أن يسبب حروقًا خطيرة عند ملامسته للجلد أو العينين أو الأغشية المخاطية. يمكن أن يؤدي استنشاق أبخرة الهيدرازين أيضًا إلى تهيج الجهاز التنفسي وتلف الرئة وفي الحالات القصوى يكون مميتًا. الهيدرازين أيضًا قابل للاشتعال ويمكن أن يشتعل بسهولة، خاصة عند ملامسته لمواد معينة مثل العوامل المؤكسدة. ونظرًا لهذه المخاطر، يجب استخدام احتياطات السلامة المناسبة ومعدات الحماية الشخصية عند التعامل مع الهيدرازين، ويجب استخدامه فقط في المناطق جيدة التهوية من قبل متخصصين مؤهلين تلقوا تدريبًا مناسبًا على السلامة.
| رموز الخطر | جمجمة وعظمتين متقاطعتين، لهب |
| وصف الأمان | لا تستخدم سوى في مناطق جيدة التهوية. ارتداء القفازات والملابس وحماية العين / الوجه. تجنب التلامس مع الجلد والاعين والملابس. الابتعاد عن الحرارة، والشرر واللهب. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 2030 |
| رمز النظام المنسق | 282510 |
| فئة الخطر | 6.1 (المواد السامة) |
| مجموعة التعبئة | ثانيا |
| تسمم | شديد السمية عند الابتلاع والاستنشاق وملامسة الجلد. قد يسبب حروقا شديدة وتلف الأنسجة. يمكن أن يؤدي التعرض طويل الأمد إلى تلف الكبد والكلى وقد يكون مسببًا للسرطان. |
طرق تصنيع الهيدرازين
يمكن تصنيع الهيدرازين بطرق مختلفة، اعتمادًا على النقاء المطلوب والاستخدام المحدد. بعض الطرق الشائعة لتصنيع الهيدرازين هي:
- عملية راشيج: تتضمن هذه الطريقة تفاعل الأمونيا وهيبوكلوريت الصوديوم في وجود عامل محفز مثل النحاس أو النيكل.
- عملية أولين-راشيج: تتضمن هذه العملية تفاعل اليوريا وحمض الهيدروكلوريك لإنتاج هيدرات الهيدرازين.
- عملية الكيتازين: تتضمن هذه العملية تفاعل الأسيتون مع الأمونيا في وجود عامل محفز مثل نيكل راني.
- عملية البيروكسيد: تتضمن هذه العملية تفاعل بيروكسيد الهيدروجين والأمونيا في وجود عامل محفز مثل البلاتين أو البلاديوم.
- عملية باير: تتضمن هذه العملية تفاعل هيبوكلوريت الصوديوم مع اليوريا في وجود عامل محفز مثل النحاس أو النيكل.
- تفاعل هوبن-هوش: يتضمن هذا التفاعل تفاعل حمض النيتروز مع الأمونيا في وجود عامل مختزل مثل الزنك.
كل طريقة لها مزاياها وعيوبها، واختيار الطريقة سوف يعتمد على عوامل مثل اعتبارات التكلفة والإنتاج والنقاء والسلامة. يجب أن يتم تصنيع الهيدرازين بحذر، حيث أن الهيدرازين مادة خطرة ويمكن أن تشكل خطراً على صحة الإنسان وسلامته إذا لم يتم التعامل معه بشكل صحيح.
استخدامات الهيدرازين
يحتوي N2H4 على مجموعة واسعة من التطبيقات الصناعية والتجارية والعسكرية بسبب خصائصه الكيميائية الفريدة. تتضمن بعض الاستخدامات الشائعة لـ N2H4 ما يلي:
- تستخدم الشركات N2H4 كوقود للصواريخ بسبب محتواه العالي من الطاقة واستقراره.
- ويستخدم N2H4 كعامل بلمرة في إنتاج بوليمرات معينة، بما في ذلك النايلون والكيفلر.
- يستخدم الكيميائيون N2H4 كعامل اختزال في تفاعلات التخليق الكيميائي، وخاصة في إنتاج الأدوية والمبيدات الحشرية والمركبات العضوية الأخرى.
- يعمل N2H4 كعامل اختزال في عمليات طلاء المعادن، وخاصةً في طلاء النيكل.
- تستخدم محطات معالجة المياه N2H4 كمنظف للأكسجين، خاصة في الغلايات وأبراج التبريد.
- يستخدم المصورون N2H4 كمطور للتصوير الفوتوغرافي، خاصة في التصوير الفوتوغرافي بالأبيض والأسود.
- يعتمد مصنعو السيارات على N2H4 كنافخ في أنظمة الوسائد الهوائية للسيارات.
- تستخدم الصناعات N2H4 كعامل تنظيف لبعض المعدات والأسطح، خاصة في صناعة الإلكترونيات.
على الرغم من أن الهيدرازين له العديد من التطبيقات المفيدة، إلا أنه أيضًا مادة خطرة ويجب التعامل معه بحذر. يجب استخدام احتياطات السلامة ومعدات الحماية الشخصية المناسبة عند التعامل مع الهيدرازين، ويجب استخدامها فقط من قبل المتخصصين المؤهلين الذين تلقوا التدريب المناسب على السلامة.
أسئلة:
ما هو رقم الأكسدة (حالة الأكسدة) لـ N في N2H4؟
في N2H4، رقم الأكسدة (حالة الأكسدة) لـ N هو -2. كل ذرة هيدروجين لها رقم أكسدة +1، وبما أن N2H4 جزيء متعادل، فإن مجموع أرقام الأكسدة لجميع الذرات يجب أن يساوي الصفر. نظرًا لوجود ذرتين من النيتروجين في N2H4، فإن إجمالي عدد الأكسدة للنيتروجين في الجزيء هو -4. ولذلك فإن عدد تأكسد كل ذرة نيتروجين هو -2، وهو ما يوازن أعداد تأكسد ذرات الهيدروجين.
ما اسم المركب N2H4 ؟
يُسمى المركب N2H4 عادةً بالهيدرازين.
ما هي النسب المولية للهيدرازين (n2h4) إلى بيروكسيد الهيدروجين (h2o2) والهيدرازين إلى الماء؟
يمكن تحديد النسب المولية للهيدرازين (N2H4) إلى بيروكسيد الهيدروجين (H2O2) والهيدرازين إلى الماء من المعادلات الكيميائية المتوازنة للتفاعلات المعنية.
عندما يتفاعل الهيدرازين مع بيروكسيد الهيدروجين ينتج غاز النيتروجين (N2) والماء (H2O) وغاز الأكسجين (O2) وفق المعادلة الموزونة التالية:
N2H4 + H2O2 → N2 + 2H2O + O2
وفقا لهذه المعادلة، فإن النسبة المولية للهيدرازين إلى بيروكسيد الهيدروجين هي 1:1. وهذا يعني أنه مقابل كل مول من الهيدرازين المستخدم في التفاعل، يتم استهلاك مول واحد من بيروكسيد الهيدروجين.
عندما يتفاعل الهيدرازين مع الماء، فإنه يشكل هيدرازين هيدرازين، الذي له الصيغة الكيميائية N2H4 · H2O. المعادلة الكيميائية المتوازنة لهذا التفاعل هي:
N2H4 + H2O → N2H4·H2O
وفقا لهذه المعادلة، فإن نسبة الهيدرازين إلى الماء المولية هي 1:1. وهذا يعني أنه مقابل كل مول من الهيدرازين المستخدم في التفاعل، يتم استهلاك مول واحد من الماء ويتم إنتاج مول واحد من هيدرات الهيدرازين.
