الفلوروميثان (CH3F) هو غاز عديم اللون ذو رائحة أثيرية طفيفة. يتم استخدامه في إنتاج الإلكترونيات والأدوية وكمبرد. وهي ليست شديدة السمية ولكنها تشكل غازات دفيئة قوية.
| اسم الأيوباك | الفلوروميثان |
| الصيغة الجزيئية | CH3F |
| CAS رقم | 593-53-3 |
| المرادفات | فلوريد الميثيل، فريون 41، هالوكربون 41، آر 41، رقم الأمم المتحدة 2452 |
| إنتشي | إنتشي = 1S/CH3F/c1-2/h1H3 |
خصائص الفلوروميثان
نقطة الغليان CH3F
نقطة غليان CH3F هي -78.4 درجة مئوية، وهي منخفضة نسبيًا. وهذا يجعله مبردًا مثاليًا لمختلف التطبيقات مثل أنظمة التبريد وتكييف الهواء. يستخدم CH3F أيضًا كوقود دافع في الهباء الجوي نظرًا لانخفاض نقطة غليانه.
CH3F الكتلة المولية
CH3F هو مركب كيميائي له الصيغة الجزيئية CH3F. يُعرف أيضًا باسم فلوريد الميثيل وله كتلة مولية تبلغ 34.03 جم / مول. CH3F هو غاز عديم اللون ذو رائحة أثيرية طفيفة ويستخدم على نطاق واسع في تطبيقات مختلفة بسبب خصائصه الفريدة.
نقطة الانصهار CH3F
تبلغ نقطة انصهار CH3F -141 درجة مئوية، وهي أيضًا منخفضة نسبيًا. نقطة انصهاره المنخفضة تجعل من السهل التعامل معه ونقله، مما يجعله خيارًا شائعًا لمختلف التطبيقات الصناعية. كما أن نقطة الانصهار المنخفضة لـ CH3F تجعله مناسبًا للاستخدام كمبرد في تطبيقات درجات الحرارة المنخفضة.
الكثافة CH3F
تبلغ كثافة CH3F 0.89 جم / مل، وهي منخفضة نسبيًا. وهذا يجعله أقل كثافة من الهواء الذي تبلغ كثافته 1.29 جم/مل. ونتيجة لذلك، غالبًا ما يستخدم CH3F كغاز أخف من الهواء في تطبيقات مختلفة، بما في ذلك اكتشاف التسرب، والاستشراب الغازي، وكغاز رفع للبالونات والمناطيد.
الوزن الجزيئي CH3F
يبلغ الوزن الجزيئي لـ CH3F 34.03 جم/مول، وهو منخفض نسبيًا. وهذا يجعله مركبًا خفيف الوزن يسهل التعامل معه ونقله. غالبًا ما يستخدم CH3F في إنتاج الإلكترونيات والمستحضرات الصيدلانية نظرًا لوزنه الجزيئي المنخفض وخصائصه الفريدة.
هيكل CH3F
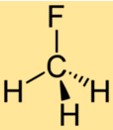
يتكون هيكل CH3F من ذرة كربون واحدة مرتبطة بثلاث ذرات هيدروجين وذرة فلور واحدة. ترتبط ذرة الفلور بذرة الكربون لتحل محل إحدى ذرات الهيدروجين في الميثان. هيكل CH3F يجعله مركبًا مستقرًا ذو خصائص كيميائية فريدة.
صيغة الفلوروميثان
صيغة الفلوروميثان هي CH3F، والتي تمثل ترتيب الذرات في الجزيء. توضح الصيغة أن الفلوروميثان يتكون من ذرة كربون واحدة، وثلاث ذرات هيدروجين، وذرة فلور واحدة. تُستخدم الصيغة لوصف التركيب الكيميائي للفلوروميثان وهي مهمة في التطبيقات المختلفة.
| مظهر | غاز عديم اللون |
| جاذبية معينة | 0.89 عند 20 درجة مئوية (الهواء = 1) |
| لون | عديم اللون |
| يشم | رائحة أثيرية خفيفة |
| الكتلة المولية | 34.03 جم/مول |
| كثافة | 0.89 جرام/مل |
| نقطة الانصهار | -141 درجة مئوية |
| نقطة الغليان | -78.4 درجة مئوية |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | 0.5 جم/لتر عند 20 درجة مئوية |
| الذوبان | قابل للامتزاج في المذيبات العضوية |
| ضغط البخار | 4.4 بار عند 20 درجة مئوية |
| كثافة بخار | 1.43 (الهواء = 1) |
| pKa | 50.9 |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر الفلوروميثان
يعتبر الفلوروميثان عمومًا مركبًا آمنًا للتعامل والاستخدام، ومنخفض السمية وغير قابل للاشتعال. ومع ذلك، مثل أي مادة كيميائية، لديها مخاطر محتملة واعتبارات تتعلق بالسلامة. التعرض لتركيزات عالية من الفلوروميثان يمكن أن يسبب الدوخة والصداع والغثيان. وهو أيضًا أحد غازات الدفيئة القوية التي تساهم في تغير المناخ. وينبغي التعامل مع الفلوروميثان في منطقة جيدة التهوية ويجب ارتداء معدات الحماية، مثل القفازات والنظارات الواقية. من المهم اتباع إجراءات التخزين والتعامل المناسبة لتجنب التسربات والتسربات العرضية في البيئة.
| رموز الخطر | ف+ |
| وصف الأمان | غاز شديد الاشتعال؛ سامة عن طريق الاستنشاق. يسبب تهيج الجلد؛ يسبب تهيج العين خطيرة؛ قد تسبب النعاس أو الدوار؛ قد يسبب تلف الأعضاء |
| معرفات | UN2452 |
| رمز النظام المنسق | 2903.49.90 |
| فئة الخطر | 2.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سمية منخفضة، ولكن قد تسبب آثارا صحية إذا تم استنشاقها بتركيزات عالية. |
طرق تخليق الفلوروميثان
هناك عدة طرق، بما في ذلك الفلورة المباشرة للميثان وتفاعلات تبادل الهالوجين، يمكنها تصنيع الفلوروميثان.
إحدى الطرق الشائعة هي تفاعل الميثانول مع فلوريد الهيدروجين في وجود عامل محفز، مثل أكسيد الألومنيوم أو فلوريد الألومنيوم.
تتضمن الطريقة الأخرى تفاعل الكلوروميثان أو البروموميثان مع غاز فلوريد الهيدروجين. تنتج كلتا الطريقتين الفلوروميثان كمنتج ثانوي، والذي يمكن بعد ذلك فصله وتنقيته بالتقطير أو بطرق أخرى.
هناك طريقة أخرى لتصنيع الفلوروميثان تتضمن تفاعل الفلوروفورم وكلوريد الهيدروجين في وجود محفز، مثل الزنك أو النحاس. ينتج عن هذا التفاعل خليط من كلوروفلوروميثان وفلوروميثان، والذي يمكن فصله وتنقيته بالتقطير.
استخدامات الفلوروميثان
للفلوروميثان عدة استخدامات في صناعات مختلفة، منها:
- التبريد: يستخدم كمبرد في أنظمة التبريد الصناعية والتجارية بسبب انخفاض درجة غليانه وعدم قابليته للاشتعال.
- الإلكترونيات: يستخدم كعامل تنظيف للمكونات الإلكترونية وكعامل حفر البلازما في صناعة أشباه الموصلات.
- التطبيقات الطبية: يستخدم كمخدر في الطب البيطري بسبب سميته المنخفضة ومفعوله السريع.
- إنتاج المبيدات الحشرية: تستخدم كمقدمة في إنتاج بعض المبيدات الحشرية، بما في ذلك مبيدات الأعشاب والمبيدات الحشرية.
- إنتاج البوليمر: يستخدم كعامل نفخ في إنتاج رغاوي البوليمر، مثل رغوة البولي يوريثان.
- التطبيقات المخبرية: يستخدم كمذيب وكاشف في العديد من التطبيقات المخبرية، بما في ذلك التركيب والتحليل الكيميائي.
- إخماد الحرائق: يستخدم أيضًا كعامل إخماد للحرائق في بعض أنواع طفايات الحريق، خاصة تلك المستخدمة في غرف الكمبيوتر والاتصالات.
أسئلة:
س: هل CH3F قطبي أم غير قطبي؟
ج: CH3F هو جزيء قطبي بسبب الترتيب غير المتماثل لذرات الفلور والهيدروجين حول ذرة الكربون المركزية، مما يؤدي إلى عزم ثنائي القطب الصافي.
س: هل يحتوي CH3F على رابطة هيدروجينية؟
ج: لا يحتوي الفلوروميثان على رابطة هيدروجينية لأنه لا يحتوي على ذرة هيدروجين مرتبطة بعنصر عالي السالبية الكهربية مثل النيتروجين أو الأكسجين أو الفلور.
س: ما المركب الذي له أقوى القوى بين الجزيئية: HF، CH3Cl، CH3F، HCl؟
ج: يتمتع HF بأقوى القوى بين الجزيئات نظرًا لقدرته على تكوين روابط هيدروجينية، وهي أقوى من قوى ثنائي القطب ثنائي القطب للمركبات الأخرى.
س: ما هي أضعف قوى ثنائية القطب: N2، CO، CH3F، HCl؟
ج: N2 لديه أقل قوى ثنائي القطب ثنائي القطب لأنه جزيء غير قطبي، وبالتالي ليس لديه عزم ثنائي قطب صافي. CO وCH3F وHCl هي جزيئات قطبية ولها قوى ثنائية القطب، لكن قوة هذه القوى تزداد بالترتيب HCl <CH3F <CO بسبب زيادة قطبية الجزيئات.
