النيتروبنزين أو C6H5NO2 هو مركب عضوي ذو لون أصفر شاحب ورائحة مميزة. يتم استخدامه كمقدمة لإنتاج الأنيلين والمواد الكيميائية الأخرى. وهي أيضًا مادة سامة.
| اسم الأيوباك | النيتروبنزين |
| الصيغة الجزيئية | C6H5NO2 |
| CAS رقم | 98-95-3 |
| المرادفات | نيتروبنزول، نيتروبنزين، ميربان إيسينس، NB |
| إنتشي | إنشي=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
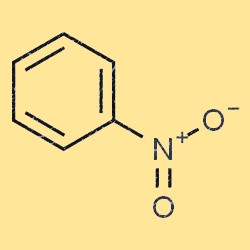
هيكل النتروبنزين
يحتوي النيتروبنزين على بنية جزيئية مسطحة ومستوية. ويتكون من حلقة بنزين (C6H5) مع مجموعة نيترو (-NO2) متصلة بإحدى ذرات الكربون. مجموعة النيترو هي مجموعة تسحب الإلكترون، مما يعني أنها تقلل من كثافة الإلكترون في حلقة البنزين. هذه الخاصية تجعل النيتروبنزين أقل تفاعلاً من البنزين في العديد من التفاعلات الكيميائية.
صيغة النتروبنزين
الصيغة الكيميائية للنيتروبنزين هي C6H5NO2. تمثل هذه الصيغة عدد ونوع الذرات التي يتكون منها الجزيء. تشكل حلقة البنزين العمود الفقري للجزيء، في حين تشكل مجموعة النيترو مجموعة وظيفية قطبية تؤثر على خصائص المركب. تعتبر صيغة النيتروبنزين مهمة لفهم خواصه الكيميائية والفيزيائية بالإضافة إلى تفاعله مع المواد الأخرى.
الكتلة المولية للنيتروبنزين
الكتلة المولية للنيتروبنزين، والتي تسمى أيضًا C6H5NO2، هي 123.11 جم/مول. ويتم حساب ذلك عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في المركب. يمتلك النيتروبنزين كتلة مولية عالية نسبيًا، وذلك بسبب وجود ست ذرات كربون وذرة نيتروجين واحدة في تركيبه الكيميائي.
نقطة غليان النتروبنزين
درجة غليان النيتروبنزين هي 210.9 درجة مئوية. وهذا مرتفع نسبيًا مقارنة بالمركبات العضوية الأخرى ذات الأوزان الجزيئية المماثلة. ترجع نقطة الغليان المرتفعة إلى وجود قوى تجاذب بين الجزيئات قوية بين جزيئات النيتروبنزين، مثل الروابط الهيدروجينية والتفاعلات ثنائية القطب.
نقطة انصهار النيتروبنزين
نقطة انصهار النيتروبنزين هي 5.85 درجة مئوية. وهذا منخفض نسبيًا مقارنة بنقطة غليانه، وهو ما يمكن تفسيره بحقيقة أن قوى الجذب بين الجزيئات في الحالة الصلبة أضعف منها في الحالة السائلة. بالإضافة إلى ذلك، يمكن أن يظهر النيتروبنزين تعدد الأشكال، مما يعني أنه يمكن أن يتواجد في هياكل بلورية متعددة بنقاط انصهار مختلفة.
كثافة النيتروبنزين جم/مل
تبلغ كثافة النيتروبنزين 1.20 جم/مل عند درجة حرارة الغرفة (25 درجة مئوية). وهذا يعني أن النيتروبنزين أكثر كثافة من الماء، الذي تبلغ كثافته 1 جم / مل عند نفس درجة الحرارة. تتأثر كثافة النيتروبنزين بوزنه الجزيئي وحجم وشكل جزيئاته.
الوزن الجزيئي للنيتروبنزين
الوزن الجزيئي للنيتروبنزين هو 123.11 جم / مول. ويتم حساب ذلك عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في المركب. الوزن الجزيئي للنيتروبنزين مهم في تحديد خصائصه الفيزيائية والكيميائية، مثل درجة الغليان، ونقطة الانصهار، والذوبان.
| مظهر | سائل أصفر شاحب |
| جاذبية معينة | 1.20 جم/سم3 |
| لون | أصفر شاحب |
| يشم | صفة مميزة |
| الكتلة المولية | 123.11 جم/مول |
| كثافة | 1.20 جم/مل عند 25 درجة مئوية |
| نقطة الانصهار | 5.85 درجة مئوية |
| نقطة الغليان | 210.9 درجة مئوية |
| نقطة فلاش | 77 درجة مئوية |
| الذوبان في الماء | 7.9 جم/لتر عند 25 درجة مئوية |
| الذوبان | قابل للذوبان في المذيبات العضوية |
| ضغط البخار | 0.68 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 4.35 (الهواء=1) |
| pKa | -1.15 |
| الرقم الهيدروجيني | 7 (محايد) |
السلامة ومخاطر النيتروبنزين
النيتروبنزين مادة شديدة السمية وتشكل العديد من المخاطر على السلامة والصحة. قد يسبب تهيج الجلد والعينين والجهاز التنفسي عن طريق الاتصال أو الاستنشاق. التعرض لفترات طويلة للنيتروبنزين يمكن أن يسبب تلف الكبد والكلى وفقر الدم وميثيموغلوبينية الدم. النيتروبنزين أيضًا قابل للاشتعال جدًا ويمكن أن يشتعل عند درجات حرارة منخفضة نسبيًا. بالإضافة إلى ذلك، يمكن أن تطلق أبخرة سامة عند تسخينها أو حرقها أو تحللها. لذلك من الضروري التعامل مع النيتروبنزين بحذر، وارتداء معدات الحماية المناسبة وتخزينه في مكان بارد وجاف، بعيدًا عن مصادر الاشتعال والمواد غير المتوافقة.
| رموز الخطر | تي، ن |
| وصف الأمان | سام جدًا، ضار إذا تم ابتلاعه أو استنشاقه أو امتصاصه عن طريق الجلد، ويسبب حروقًا شديدة في الجلد وتلفًا للعين. |
| معرفات | UN1662 |
| رمز النظام المنسق | 2904.90.90 |
| فئة الخطر | 6.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سام جدا |
طرق تصنيع النيتروبنزين
يمكن تصنيع النيتروبنزين بعدة طرق، بما في ذلك نترات البنزين، واختزال النيتروبنزين، وهدرجة النيتروبنزين. الطريقة الأكثر استخدامًا هي نترات البنزين، والتي تتضمن تفاعل البنزين مع خليط من حمض النيتريك وحمض الكبريتيك عند درجة حرارة حوالي 50 درجة مئوية. ينتج عن تفاعل النترات خليط من النيتروبنزين، بالإضافة إلى مشتقات نيترو أخرى من البنزين.
طريقة أخرى لتصنيع النيتروبنزين هي اختزال النيتروبنزين، والذي يتضمن استخدام عوامل الاختزال مثل الحديد أو الزنك وحمض الهيدروكلوريك. يقوم تفاعل الاختزال بتحويل مجموعة النيترو (-NO2) من النيتروبنزين إلى مجموعة أمينية (-NH2)، مما ينتج الأنيلين كمنتج ثانوي.
هدرجة النيتروبنزين هي طريقة أخرى لتخليق الأنيلين. تتضمن هذه الطريقة استخدام محفز، مثل النيكل أو البلاديوم، وغاز الهيدروجين، الذي يتفاعل مع النيتروبنزين لإنتاج الأنيلين.
استخدامات النتروبنزين
النيتروبنزين هو مادة كيميائية متعددة الاستخدامات تستخدم في مجموعة واسعة من التطبيقات.
- تستخدم الصناعة الكيميائية النيتروبنزين كمقدمة للأنيلين، وهو عنصر مهم في إنتاج الأصباغ والمطاط والمستحضرات الصيدلانية. ويعد النيتروبنزين مادة خام قيمة لصناعة مواد كيميائية أخرى مثل الفينول، المستخدم في إنتاج البلاستيك والراتنجات والمواد اللاصقة.
- يمكن إذابة المركبات العضوية مثل الزيوت والدهون والشموع باستخدام النيتروبنزين، مما يجعله مذيبًا مفيدًا. في صناعة المواد الغذائية، يستخدم النتروبنزين كمادة منكهة، وخاصة في إنتاج العلكة.
- يعد C6H5NO2 مكونًا أساسيًا في إنتاج المتفجرات مثل مادة TNT (ثلاثي نيتروتولوين). باعتباره مادة مضافة للوقود، يساعد النتروبنزين على زيادة تصنيف الأوكتان للبنزين.
- ويستخدم C6H5NO2 أيضًا في صناعة المبيدات الحشرية ومبيدات الأعشاب المختلفة، بما في ذلك المبيدات الحشرية ومبيدات الفطريات.
- يعتمد إنتاج الألياف الاصطناعية مثل النايلون أيضًا على النيتروبنزين كمكون أساسي.
بشكل عام، فإن الطبيعة المتنوعة للنيتروبنزين تجعله مادة كيميائية أساسية في العديد من الصناعات، بما في ذلك الصناعات الكيميائية والغذائية والنسيجية. ومع ذلك، فإن التعامل السليم واحتياطات السلامة ضرورية عند استخدام النيتروبنزين بسبب سميته وقابليته للاشتعال.
أسئلة:
تفاعل النتروبنزين مع الأنيلين
تحويل النيتروبنزين إلى الأنيلين هو تفاعل من خطوتين يتضمن اختزال مجموعة النيترو (-NO2) إلى مجموعة أمينية (-NH2) والتحلل المائي اللاحق للمنتج الوسيط.
يتم عادةً اختزال C6H5NO2 باستخدام عامل اختزال، مثل الحديد أو الزنك، ومحلول حمضي، مثل حمض الهيدروكلوريك. ينتج عن التفاعل منتج وسيط، وهو النيتروسوبنزين، والذي يتم بعد ذلك اختزاله إلى الأنيلين في وجود محفز حمضي أو قاعدي.
يتم تحقيق التحلل المائي للنيتروسوبنزين الوسيط إلى الأنيلين عن طريق معالجة الوسيط بمحلول حمضي، مثل حمض الهيدروكلوريك المخفف. وينتج عن التفاعل الأنيلين، بالإضافة إلى الماء وأكسيد النيتروجين (NO).
يمكن تمثيل التفاعل الكلي على النحو التالي: Nitrobenzene + 3 H2 → Aniline + 2 H2O + N2
