الإيثانول أو C2H6O هو كحول عديم اللون وقابل للاشتعال مشتق من مواد نباتية، وغالبًا ما يستخدم كوقود حيوي أو مذيب. وهو أيضًا عنصر شائع في المشروبات الكحولية.
| اسم الأيوباك | الإيثانول |
| الصيغة الجزيئية | C2H6O |
| CAS رقم | 64-17-5 |
| المرادفات | الكحول الإيثيلي، كحول الحبوب، EtOH، الكحول |
| إنتشي | إنتشي = 1S/C2H6O/c1-2-3/h3H،2H2،1H3 |
خصائص الإيثانول
هيكل لويس C2H6O
يمكن رسم بنية لويس لـ C2H6O (المعروف أيضًا باسم الإيثانول) على النحو التالي:
ح ح
| |
HCCOH
| |
ح ح
في هذا الهيكل، ترتبط ذرتا الكربون ببعضهما البعض بواسطة رابطة تساهمية واحدة. ترتبط كل ذرة كربون أيضًا بثلاث ذرات هيدروجين وترتبط ذرة كربون واحدة بذرة أكسجين واحدة. ترتبط ذرة الأكسجين بذرة الكربون برابطة تساهمية واحدة ولها زوجان من الإلكترونات الحرة.
يتوافق هذا الهيكل مع قاعدة الثماني، التي تنص على أن كل ذرة في الجزيء يجب أن تحتوي على ثمانية إلكترونات في غلاف التكافؤ الخاص بها. تحتوي ذرات الكربون على أربعة إلكترونات في غلاف التكافؤ الخاص بها، بينما تحتوي ذرات الهيدروجين على إلكترون واحد لكل منها. تحتوي ذرة الأكسجين على ستة إلكترونات تكافؤ، ومع وجود زوجين وحيدين إضافيين، فإنها تحقق قاعدة الثماني.
C2H6O الكتلة المولية
يحتوي الإيثانول على كتلة مولية تبلغ حوالي 46.07 جم / مول. يتم تعريف الكتلة المولية للمادة على أنها كتلة مول واحد من تلك المادة. وفي حالة الإيثانول، يحتوي مول واحد من الإيثانول على ما يقرب من 46.07 جرامًا من المادة. تعد الكتلة المولية معلمة مفيدة في الحسابات الكيميائية لأنها تسمح بالتحويل بين كتلة المادة وعدد مولاتها.
نقطة غليان الإيثانول
تبلغ درجة غليان الإيثانول حوالي 78.5 درجة مئوية (173.3 درجة فهرنهايت) عند الضغط القياسي. تسهل نقطة الغليان المنخفضة نسبيًا تبخر الإيثانول، وهو مفيد في العديد من العمليات الصناعية. على سبيل المثال، يستخدم الإيثانول بشكل شائع كمذيب في إنتاج المستحضرات الصيدلانية والعطور والمواد الكيميائية الأخرى.
نقطة انصهار الإيثانول
الإيثانول لديه نقطة انصهار تبلغ حوالي -114.1 درجة مئوية (-173.4 درجة فهرنهايت). نقطة الانصهار المنخفضة هذه تجعل الإيثانول سائلاً في درجة حرارة الغرفة، ولهذا السبب يتم استخدامه بشكل شائع في شكل سائل كمذيب أو وقود. درجة انصهار الإيثانول أقل من درجة انصهار الماء، مما يسمح باستخدام الإيثانول كمضاد للتجمد في أنظمة تبريد السيارات.
كثافة الإيثانول جم / مل
تبلغ كثافة الإيثانول حوالي 0.789 جم / مل عند درجة الحرارة والضغط القياسيين. وهذا يعني أن مليلتر واحد من الإيثانول يزن 0.789 جرام. كثافة الإيثانول أقل من كثافة الماء الذي تبلغ كثافته 1 جم / مل عند درجة الحرارة والضغط القياسيين. وهذا يعني أن الإيثانول سوف يطفو على سطح الماء.
الوزن الجزيئي للإيثانول
يبلغ الوزن الجزيئي للإيثانول حوالي 46.07 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. وفي حالة الإيثانول، فهو يحتوي على ذرتي كربون وست ذرات هيدروجين وذرة أكسجين واحدة. يستخدم الوزن الجزيئي لحساب عدد مولات المادة في كتلة معينة من المادة.
هيكل الإيثانول
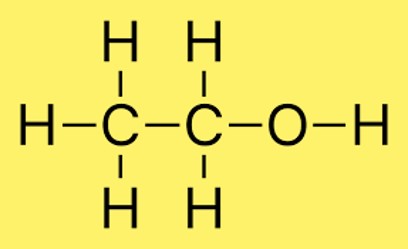
في بنية الإيثانول، ترتبط ذرتان كربون من خلال رابطة واحدة وثلاث ذرات هيدروجين مع كل ذرة كربون. بالإضافة إلى ذلك، ترتبط ذرة الهيدروجين بذرة الأكسجين. عادة ما يتم تمثيل ترتيب الذرات في الجزيء بواسطة CH3CH2OH.
صيغة الإيثانول
الصيغة الكيميائية للإيثانول هي C2H6O. توضح هذه الصيغة عدد ونوع الذرات الموجودة في الجزيء. يمكن استخدام الصيغة لحساب الوزن الجزيئي للإيثانول، بالإضافة إلى عدد مولات الإيثانول في كتلة معينة من المادة. الصيغة مفيدة أيضًا للتنبؤ بالسلوك الكيميائي للإيثانول في التفاعلات مع المواد الكيميائية الأخرى.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.789 |
| لون | عديم اللون |
| يشم | رائحة مميزة |
| الكتلة المولية | 46.07 جرام/مول |
| كثافة | 0.789 جم/مل |
| نقطة الانصهار | -114.1 درجة مئوية (-173.4 درجة فهرنهايت) |
| نقطة الغليان | 78.5 درجة مئوية (173.3 درجة فهرنهايت) عند الضغط القياسي |
| نقطة فلاش | 13 درجة مئوية (55 درجة فهرنهايت) |
| الذوبان في الماء | قابلة للامتزاج |
| الذوبان | قابل للذوبان في المذيبات القطبية وغير القطبية |
| ضغط البخار | 44.6 كيلو باسكال عند 20 درجة مئوية |
| كثافة بخار | 1.59 (الهواء = 1) |
| pKa | 15.9 إلى 25 درجة مئوية |
| الرقم الهيدروجيني | 7 (محايد) |
سلامة ومخاطر الإيثانول
الإيثانول هو سائل قابل للاشتعال ويمكن أن يشكل خطر الحريق والانفجار إذا لم يتم التعامل معه بشكل صحيح. يمكن أيضًا أن تشتعل أبخرة الإيثانول بسهولة وتشكل خطرًا كبيرًا على الحريق. يمكن أن يكون الإيثانول ضارًا أيضًا إذا تم تناوله، وقد يؤدي الاستهلاك المفرط إلى التسمم بالكحول. استنشاق كميات كبيرة من بخار الإيثانول يمكن أن يسبب الدوخة والصداع والغثيان. التعرض لفترات طويلة للإيثانول يمكن أن يسبب أيضًا تهيج الجلد وجفافه. يجب تخزين الإيثانول في مكان بارد وجيد التهوية بعيدًا عن مصادر الاشتعال والمواد غير المتوافقة. وينبغي استخدام معدات الحماية المناسبة، مثل القفازات ونظارات السلامة، عند التعامل مع الإيثانول.
| رموز الخطر | ف، شي، فلام. سائل. 2 |
| وصف الأمان | الابتعاد عن الحرارة والشرر واللهب المكشوف والأسطح الساخنة. ممنوع التدخين. استخدم معدات كهربائية ومعدات تهوية وإضاءة مقاومة للانفجار. تجنب استنشاق الأبخرة. ارتداء القفازات الواقية، والنظارات الواقية. في حالة نشوب حريق: استخدم مسحوق كيميائي جاف أو ثاني أكسيد الكربون أو رذاذ الماء أو الرغوة للإطفاء. تخلص من المحتويات/الحاوية وفقًا للوائح المحلية/الإقليمية/الوطنية/الدولية. |
| معرفات | UN1170 |
| رمز النظام المنسق | 2207.10.00 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثانيا |
| تسمم | يمكن أن يكون الإيثانول سامًا إذا تم تناوله أو استنشاقه بكميات كبيرة. التعرض لفترات طويلة يمكن أن يسبب أيضًا تهيجًا وجفافًا للجلد. يمكن أن يؤدي الابتلاع المزمن إلى إدمان الكحول ومشاكل صحية أخرى. |
طرق تصنيع الإيثانول
يمكن تصنيع الإيثانول بطرق مختلفة، بما في ذلك التخمير، وترطيب الإيثيلين المباشر، وتحويل الكتلة الحيوية.
التخمير هو الطريقة الأكثر شيوعًا لإنتاج الإيثانول ويتضمن تحويل السكريات والكربوهيدرات الأخرى إلى إيثانول بواسطة الكائنات الحية الدقيقة مثل الخميرة. وتستخدم هذه العملية لإنتاج الإيثانول من محاصيل مثل الذرة والشعير وقصب السكر، وكذلك من النفايات مثل مخلفات الطعام والمخلفات الزراعية.
يعد الترطيب المباشر للإيثيلين طريقة أخرى لإنتاج الإيثانول. في هذه العملية، يتفاعل الإيثيلين مع الماء في وجود محفز مثل حمض الفوسفوريك لتكوين الإيثانول. تُستخدم هذه الطريقة بشكل شائع في البيئات الصناعية وهي أكثر كفاءة من التخمير.
يعد تحويل الكتلة الحيوية طريقة أخرى لإنتاج الإيثانول ويتضمن تحويل المواد النباتية مثل رقائق الخشب والأعشاب والمخلفات الزراعية إلى إيثانول. تتضمن العملية تحطيم السليلوز والهيميسليلوز الموجود في المواد النباتية إلى سكريات بسيطة يمكن تخميرها إلى إيثانول.
تشمل الطرق الأخرى لإنتاج الإيثانول تحويل ثاني أكسيد الكربون التحفيزي وتخفيض ثاني أكسيد الكربون الكهروكيميائي.
ولكل من هذه الطرق مزاياها وعيوبها، ويعتمد اختيار الطريقة على عوامل مثل توافر المواد الخام والتكلفة والفعالية. يظل التخمير الطريقة الأكثر استخدامًا لإنتاج الإيثانول نظرًا لفعاليته من حيث التكلفة وموثوقيته.
استخدامات الإيثانول
للإيثانول مجموعة واسعة من الاستخدامات الصناعية والتجارية والشخصية. بعض استخداماته الشائعة تشمل:
- يزيد الإيثانول من مستويات الأوكتان ويقلل الانبعاثات عند استخدامه كمادة مضافة للبنزين.
- الإيثانول هو مذيب متعدد الاستخدامات يستخدم عادة في إنتاج المنتجات الصيدلانية ومستحضرات التجميل والعناية الشخصية.
- تحتوي المشروبات الكحولية مثل البيرة والنبيذ والمشروبات الروحية على الإيثانول كعنصر نشط.
- تستخدم معقمات الأيدي ومنظفات الأسطح ومنتجات التنظيف الأخرى الإيثانول كمطهر فعال.
- يستخدم الإيثانول كمذيب في استخلاص الزيوت الأساسية والنكهات والمركبات الطبيعية الأخرى.
- يستخدم المنتجون الإيثانول كمادة خام لإنتاج مواد كيميائية أخرى، مثل حمض الأسيتيك والإيثيلين.
- تستخدم منتجات العناية الشخصية مثل العطور والمستحضرات ومنتجات العناية بالشعر الإيثانول كمكون حافظة وعطر.
- تستخدم المختبرات الكيميائية عادة الإيثانول كمذيب وكاشف.
- قد تستخدم أنظمة السيارات وأنظمة التبريد الأخرى الإيثانول كعامل مضاد للتجمد.
أسئلة:
ما عدد الذرات التي يتكون منها جزيء الإيثانول (C2H6O)؟
يتكون جزيء الإيثانول (C2H6O) من 9 ذرات: 2 ذرات كربون، 6 ذرات هيدروجين، وذرة أكسجين واحدة.
