حمض الكروميك هو عامل مؤكسد قوي ومسبب للتآكل يستخدم في مجموعة متنوعة من التطبيقات، مثل تنظيف المعادن والنقش وفي بعض التجارب المعملية. إنه أحمر اللون.
| اسم الأيوباك | حمض الكروم |
| الصيغة الجزيئية | H2CrO4 |
| CAS رقم | 7738-94-5 |
| المرادفات | حمض الكروم (VI)، حمض الكروم، ثنائي هيدروكسي ديوكسيدوكروم، ثنائي الهيدروجين (رباعي أوكسيدوكرومات) |
| إنتشي | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
خصائص حمض الكروميك
صيغة حمض الكروميك
الصيغة الكيميائية لحمض الكروم هي H2CrO4. ويتكون من ذرتين هيدروجين وذرة كروم وأربع ذرات أكسجين. تمثل الصيغة تركيبة حمض الكروم على المستوى الجزيئي.
الكتلة المولية لحمض الكروميك
يمكن حساب الكتلة المولية لحمض الكروم عن طريق إضافة الكتل الذرية للعناصر المكونة له. يحتوي الكروم على كتلة ذرية قدرها 51.996 جرامًا لكل مول، والهيدروجين له كتلة مولية قدرها 1.008 جرام لكل مول، والأكسجين لديه كتلة مولية قدرها 16.00 جرامًا لكل مول. ولذلك، فإن الكتلة المولية لحمض الكروم تبلغ حوالي 118.00 جرامًا لكل مول.
نقطة غليان حمض الكروميك
ليس لحمض الكروم نقطة غليان مميزة لأنه يتحلل عند تسخينه ويطلق غاز الأكسجين. ومع ذلك، فإن درجة حرارة تحللها تبلغ حوالي 190 درجة مئوية (374 درجة فهرنهايت). عند تسخينه، يخضع حمض الكروم لتفاعل كيميائي ينتج عنه تكوين ثالث أكسيد الكروم والماء.
نقطة انصهار حمض الكروميك
لم يتم تحديد نقطة انصهار حمض الكروم بشكل جيد بسبب ميله إلى التحلل قبل الذوبان. ومع ذلك، فمن المعروف أن حمض الكروم يمكن أن يتحلل عند حوالي 250 درجة مئوية (482 درجة فهرنهايت) أو حتى درجات حرارة أقل، اعتمادًا على الظروف.
كثافة حمض الكروميك جم/مل
تبلغ كثافة حمض الكروم حوالي 1.2 جرام لكل ملليلتر (جم / مل) في درجة حرارة الغرفة. تشير قيمة الكثافة هذه إلى أن حمض الكروم كثيف نسبيًا مقارنة بالماء.
الوزن الجزيئي لحمض الكروميك
يتم حساب الوزن الجزيئي لحمض الكروم عن طريق إضافة الكتل الذرية للعناصر المكونة له. في هذه الحالة، يبلغ الوزن الجزيئي حوالي 118.00 جرامًا لكل مول.
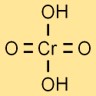
هيكل حمض الكروميك
يتم تمثيل بنية حمض الكروم بواسطة ذرة كروم مركزية مرتبطة بأربع ذرات أكسجين وذرتين هيدروجين. تترتب ذرات الأكسجين حول ذرة الكروم على شكل رباعي السطوح.
ذوبان حمض الكروميك
حمض الكروم قابل للذوبان بشكل معتدل في الماء، مما يعني أنه يمكن أن يذوب إلى حد ما. تزداد الذوبان مع زيادة درجة الحرارة. ومع ذلك، يجب التعامل معها بحذر لأنها مادة قابلة للتآكل.
| مظهر | بلورات حمراء داكنة |
| جاذبية معينة | 2.70 |
| لون | أحمر |
| يشم | عديم الرائحة |
| الكتلة المولية | 118.01 جم/مول |
| كثافة | 1,201 جم/مل |
| نقطة الانصهار | يتحلل عند ~ 190 درجة مئوية |
| نقطة الغليان | يتحلل عند ~ 250 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والمذيبات العضوية مثل الإيثانول والأثير |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | -0.64 |
| الرقم الهيدروجيني | حمضية جدًا (الرقم الهيدروجيني <1) |
سلامة ومخاطر حمض الكروميك
يشكل حمض الكروم العديد من مخاطر السلامة ويجب التعامل معه بحذر. وهي مادة قابلة للتآكل ويمكن أن تسبب حروقًا شديدة في الجلد والعينين والجهاز التنفسي عند ملامستها. قد يؤدي استنشاق أبخرة أو رذاذ حمض الكروم إلى تهيج الجهاز التنفسي ويسبب السعال وضيق التنفس وتلف الرئة. كما أنه سام جدًا إذا تم تناوله، مما يسبب آلامًا في البطن وقيءًا وتلفًا محتملاً للأعضاء. بالإضافة إلى ذلك، يعتبر حمض الكروم عامل مؤكسد قوي ويمكن أن يتفاعل بعنف أو يشعل مواد قابلة للاشتعال. يجب ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية ومعطف المختبر، عند العمل مع حمض الكروم، ويجب تخزينها والتخلص منها وفقًا لأنظمة السلامة.
| رموز الخطر | تآكل، مؤكسد |
| وصف الأمان | – يسبب حروقًا شديدة – قد نيرانًا مكثفة؛ المؤكسد – ضار في حالة ابتلاعه – يسبب تهيج الجهاز التنفسي – يسبب ضررًا للعين – قد يسبب عيوبًا وراثية – قد يسبب السرطان – قد يضر الخصوبة أو الطفل الذي لم يولد بعد – شديد السمية للحياة المائية – التعامل معه والتخلص منه بشكل صحيح |
| أرقام تعريف الأمم المتحدة | UN1755، UN1463 |
| رمز النظام المنسق | 28191000 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | الثاني (المتوسط) |
| تسمم | سامة وضارة للغاية |
طرق تصنيع حمض الكروميك
هناك عدة طرق لتجميع حمض الكروم.
تتضمن الطريقة الشائعة التفاعل بين ثاني كرومات الصوديوم (Na2Cr2O7) وحمض الكبريتيك (H2SO4) . في هذه العملية، تقوم بإضافة ثنائي كرومات الصوديوم ببطء إلى حمض الكبريتيك مع التحريك. يستمر التفاعل لتكوين حمض الكروم (H2CrO4) وكبريتات الصوديوم (Na2SO4) كمنتج ثانوي. يمكن تنقية محلول حمض الكروم الناتج وتركيزه عن طريق إزالة الماء الزائد.
على غرار الطريقة السابقة، يمكننا إضافة كرومات البوتاسيوم إلى حمض الكبريتيك ، مما يؤدي إلى تكوين حمض الكروم وكبريتات البوتاسيوم (K2SO4) كمنتج ثانوي.
بدلًا من ذلك، يمكنك تحضير حمض الكروم عن طريق تفاعل ثالث أكسيد الكروم (CrO3) مع الماء. تقوم بإذابة ثالث أكسيد الكروم في الماء، مما يؤدي إلى تكوين محلول حمض الكروم.
تذكر أن حمض الكروم مادة شديدة التآكل وخطيرة. ولذلك، ينبغي أن يتم تصنيعه مع احتياطات السلامة المناسبة وفي منطقة جيدة التهوية. ارتداء معدات الحماية، مثل القفازات والنظارات الواقية ومعطف المختبر، أثناء عملية التوليف. اتبع أيضًا طرق التخلص المناسبة لضمان التعامل والتخلص الآمن من أي نفايات تتولد أثناء عملية التوليف.
استخدامات حمض الكروميك
يجد حمض الكروم تطبيقات مختلفة بسبب خصائصه كعامل مؤكسد قوي. فيما يلي بعض الاستخدامات الشائعة:
- تنظيف المعادن: يعمل حمض الكروم على إزالة الصدأ والرواسب الكلسية والعضوية بشكل فعال من الأسطح المعدنية، وتنظيف وإزالة الملوثات السطحية.
- النقش: يقوم حمض الكروم بإنشاء أنماط وتصميمات دقيقة على الأسطح، مثل الزجاج والسيراميك والمعادن، مما يؤدي إلى نقشها وجعلها مفيدة في إنتاج الأواني الزجاجية المزخرفة وصناعة الدوائر الإلكترونية.
- تحضير السطح: تستخدم العمليات الصناعية حمض الكروم لتحضير الأسطح للطلاء أو الطلاء أو الربط، مما يضمن التصاق جيد عن طريق إزالة الشوائب وإنشاء سطح نظيف.
- الكيمياء التحليلية: يستخدم الكيميائيون والمختبرات حمض الكروم كعامل مؤكسد في التحاليل الكيميائية والتجارب المعملية، وتحديد تركيزات بعض المركبات العضوية.
- الحفاظ على الخشب: يعمل حمض الكروم كمادة حافظة للخشب، حيث يتغلغل عميقًا في ألياف الخشب لحمايته من التعفن وتفشي الحشرات والعوامل الجوية.
- صناعة النسيج: تستخدم صناعة النسيج حمض الكروم في عمليات الصباغة والطباعة وتثبيت الأصباغ في الأقمشة وتحسين ثبات اللون.
- التصوير الفوتوغرافي: يلعب حمض الكروم دورًا في بعض عمليات التصوير الفوتوغرافي، بما في ذلك إنتاج المطبوعات الملونة وأفلام عكس الألوان.
- الطلاء الكهربائي: في عمليات الطلاء الكهربائي، وخاصةً طلاء الكروم، يعمل حمض الكروم كمصدر لأيونات الكروم التي تترسب على الأسطح المعدنية، مما يوفر طبقة واقية وزخرفية.
من المهم ملاحظة أن حمض الكروم مادة خطرة ويجب اتخاذ احتياطات السلامة المناسبة عند التعامل معه وتخزينه والتخلص منه.
أسئلة:
س: ماذا يحدث عند أكسدة الفينول بحمض الكروميك؟
ج: يخضع الفينول للأكسدة مع حمض الكروم، مما يؤدي إلى تكوين الكينونات والماء.
س: كيفية تحضير حمض الكروميك؟
ج: يمكن تحضير حمض الكروم بتفاعل ثاني كرومات الصوديوم أو كرومات البوتاسيوم مع حمض الكبريتيك.
س: كيفية صنع حمض الكروميك؟
ج: يمكن تحضير حمض الكروم عن طريق خلط مركب الكروم (مثل ثالث أكسيد الكروم) مع الماء.
س: ما هو حمض الكروميك؟
ج: حمض الكروم هو عامل مؤكسد قوي ومسبب للتآكل ويتكون من الكروم والهيدروجين والأكسجين.
س: هل حمض الكروميك يختزل الألكينات؟
ج: لا، حمض الكروم هو عامل مؤكسد وليس له خصائص مختزلة.
س: كيفية تحضير حمض الكروميك لتنظيف زجاجيات المختبر؟
ج: يمكن صنع محلول تنظيف حمض الكروم عن طريق إذابة ثالث أكسيد الكروم في الماء وإضافة حمض الكبريتيك.
س: هل حمض الكروميك حمض قوي؟
ج: نعم يعتبر حمض الكروم من الأحماض القوية لقدرته على التبرع بالبروتونات.
س: كيف يمكنني تحضير محلول تنظيف حمض الكروميك؟
ج: لتحضير محلول تنظيف حمض الكروم، قم بإذابة ثالث أكسيد الكروم في الماء وأضف كمية صغيرة من حمض الكبريتيك.
س: أي من الكحولات التالية يعطي اختبار حمض الكروميك إيجابيا؟
ج: يمكن للكحولات الأولية أن تعطي نتيجة إيجابية لاختبار حمض الكروم، مما يؤدي إلى تغير اللون من البرتقالي إلى الأخضر أو الأزرق.
