الإيثان عبارة عن هيدروكربون له الصيغة الكيميائية C2H6. يستخدم عادة كوقود وهو أحد مكونات الغاز الطبيعي. يحتوي الإيثان على ذرتين كربون وست ذرات هيدروجين.
| اسم الأيوباك | الإيثان |
| الصيغة الجزيئية | C2H6 |
| CAS رقم | 74-84-0 |
| المرادفات | ثنائي إيثيل، ثنائي ميثيل، إيثيل هيدريد، ميثيل ميثان |
| إنتشي | إنتشي = 1S/C2H6/c1-2/h1-2H3 |
خصائص الإيثان
صيغة الإيثان
الصيغة الكيميائية للإيثان هي C2H6. ويشير هذا إلى أن كل جزيء إيثان يتكون من ذرتي كربون وست ذرات هيدروجين. تساعدنا الصيغة على فهم تركيبة الإيثان وترتيبه الهيكلي.
الكتلة المولية للإيثان
يتم حساب الكتلة المولية لهيدريد الإيثيل عن طريق إضافة الكتل الذرية للعناصر المكونة له. تبلغ الكتلة الذرية للكربون 12.01 جم / مول والكتلة الذرية للهيدروجين 1.008 جم / مول. ضرب الكتل الذرية بأعدادها وإضافتها يعطي الكتلة المولية لهيدريد الإيثيل، والتي تبلغ حوالي 30.07 جم / مول.
نقطة غليان الإيثان
درجة غليان هيدريد الإيثيل هي -88.6 درجة مئوية. وهذا يعني أنه عند الضغط الجوي القياسي، سيتغير هيدريد الإيثيل من سائل إلى غاز عند تسخينه إلى درجة الحرارة تلك. تعتبر نقطة الغليان خاصية مهمة لأنها تحدد الظروف التي يمكن بموجبها تبخير هيدريد الإيثيل.
نقطة انصهار الإيثان
درجة انصهار هيدريد الإيثيل هي -182.8 درجة مئوية. عند درجات حرارة أقل من هذه النقطة، يوجد هيدريد الإيثيل في صورة صلبة. عند تسخينه إلى درجة الحرارة هذه أو أعلى، يخضع هيدريد الإيثيل لتغير طوري من الحالة الصلبة إلى الحالة السائلة. تعتبر نقطة الانصهار أمرًا بالغ الأهمية لفهم السلوك الفيزيائي لهيدريد الإيثيل أثناء عمليات التبريد أو التسخين.
كثافة الإيثان جم/مل
تبلغ كثافة هيدريد الإيثيل حوالي 0.55 جم / مل عند درجة الحرارة والضغط القياسيين. الكثافة هي مقياس لكمية الكتلة الموجودة في حجم معين. وفي حالة هيدريد الإيثيل، فإنه يخبرنا بمدى إحكام تعبئة جزيئاته ويوفر نظرة ثاقبة لخصائصه الفيزيائية.
الوزن الجزيئي للإيثان
الوزن الجزيئي لهيدريد الإيثيل هو 30.07 جم / مول. وهو مجموع الكتل الذرية لجميع الذرات الموجودة في جزيء واحد من هيدريد الإيثيل. يساعدنا الوزن الجزيئي في تحديد كمية هيدريد الإيثيل الموجودة في كتلة أو حجم معين.
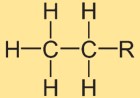
هيكل الإيثان
يتكون هيكل هيدريد الإيثيل من ذرتين كربون مرتبطتين ببعضهما البعض بواسطة رابطة تساهمية واحدة. وكل ذرة كربون محاطة بثلاث ذرات هيدروجين. الترتيب الهيكلي خطي، حيث تتوضع ذرات الهيدروجين بشكل متناظر حول الرابطة بين الكربون والكربون.
ذوبان الإيثان
هيدريد الإيثيل غير قابل للذوبان بشكل كبير في الماء. وهو جزيء غير قطبي، في حين أن الماء مذيب قطبي. تتمتع الجزيئات غير القطبية مثل هيدريد الإيثيل بقوى جزيئية ضعيفة ولا تذوب بسهولة في المذيبات القطبية. ومع ذلك، يمكن أن يذوب هيدريد الإيثيل في مذيبات أخرى غير قطبية، مثل الهكسان أو البنزين.
| مظهر | غاز عديم اللون |
| جاذبية معينة | 1.038 جم/لتر |
| لون | لا يوجد |
| يشم | عديم الرائحة |
| الكتلة المولية | 30.07 جرام/مول |
| كثافة | 0.55 جم/مل |
| نقطة الانصهار | -182.8 درجة مئوية |
| نقطة الغليان | -88.6 درجة مئوية |
| نقطة فلاش | -135 درجة مئوية |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | قابل للذوبان في المذيبات غير القطبية |
| ضغط البخار | 46.9 رطل لكل بوصة مربعة (عند 21 درجة مئوية) |
| كثافة بخار | 1.52 (الهواء = 1) |
| pKa | ~50 |
| الرقم الهيدروجيني | لا يوجد |
سلامة ومخاطر الإيثان
يقدم هيدريد الإيثيل العديد من اعتبارات ومخاطر السلامة. وهو شديد الاشتعال ويمكن أن يشكل مخاليط متفجرة مع الهواء. عند تعرضه للهب أو مصدر الحرارة، قد يشتعل هيدريد الإيثيل، مما يتسبب في نشوب حريق أو حدوث انفجارات. من المهم التعامل مع هيدريد الإيثيل وتخزينه في مناطق جيدة التهوية، بعيدًا عن مصادر الاشتعال. يشكل هيدريد الإيثيل أيضًا خطر الاختناق لأنه يحل محل الأكسجين في الأماكن المغلقة. استنشاق تركيزات عالية من هيدريد الإيثيل يمكن أن يسبب الدوخة والغثيان وحتى فقدان الوعي. من الضروري استخدام معدات الحماية الشخصية المناسبة واتباع بروتوكولات السلامة عند العمل مع هيدريد الإيثيل أو بالقرب منه للتخفيف من هذه المخاطر.
| رموز الخطر | غاز قابل للاشتعال |
| وصف الأمان | الابتعاد عن الحرارة، والشرر واللهب المكشوف. استخدام في مناطق جيدة التهوية. تعامل مع الاحتياطات المناسبة لتجنب خطر نشوب حريق أو انفجار. |
| أرقام تعريف الأمم المتحدة | UN1035 |
| رمز النظام المنسق | 29011000 |
| فئة الخطر | 2.1 (غاز قابل للاشتعال) |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | لا يعتبر الإيثان شديد السمية. ومع ذلك، فإن استنشاق تركيزات عالية يمكن أن يسبب الاختناق. استخدم مع تهوية كافية وتجنب التعرض لفترات طويلة. |
طرق تصنيع الإيثان
طرق مختلفة لتجميع هيدريد الإيثيل.
الطريقة الشائعة هي عملية التكسير بالبخار، حيث تقوم درجات الحرارة المرتفعة (حوالي 750 إلى 900 درجة مئوية) بتسخين الهيدروكربونات، عادة هيدريد الإيثيل أو الهيدروكربونات الأثقل، في وجود البخار. تؤدي هذه العملية إلى تفاعلات تشمل التحلل الحراري وإعادة الترتيب، وإنتاج هيدريد الإيثيل والإيثيلين والبروبيلين.
تتضمن الطريقة الأخرى الهدرجة الحفزية للأسيتيلين ، حيث يتفاعل غاز الأسيتيلين مع الهيدروجين فوق محفزات مناسبة مثل البلاديوم أو النيكل، منتجًا هيدريد الإيثيل. تعمل هذه الطريقة بشكل انتقائي على تحويل الأسيتيلين عالي التفاعل والذي يحتمل أن يكون خطيرًا إلى هيدريد إيثيل أكثر استقرارًا وأقل تفاعلاً.
يمكن أيضًا الحصول على الإيثان من الغاز الطبيعي عن طريق الاستخلاص المبرد. يتعرض الغاز الطبيعي، وبشكل أساسي هيدريد الميثيل، إلى درجات حرارة منخفضة وضغوط عالية لفصل واستعادة هيدريد الإيثيل. تستخدم محطات معالجة الغاز الطبيعي عادة هذه العملية لاستخراج هيدريد الإيثيل الثمين لمختلف التطبيقات الصناعية.
بالإضافة إلى ذلك، فإن تكرير البترول وبعض العمليات البتروكيماوية تولد هيدريد الإيثيل كمنتج ثانوي. تقنيات مثل التقطير أو الامتصاص تفصل هيدريد الإيثيل عن تيارات الهيدروكربون الأخرى.
بشكل عام، تتيح طرق التوليف هذه إنتاج هيدريد الإيثيل، وهو مادة خام مهمة لتصنيع مجموعة واسعة من المواد الكيميائية والبلاستيك والوقود، مما يساهم في العديد من الصناعات حول العالم.
استخدامات الإيثان
يجد هيدريد الإيثيل تطبيقًا في العديد من الصناعات نظرًا لخصائصه المتنوعة. فيما يلي بعض الاستخدامات الرئيسية لهيدريد الإيثيل:
- صناعة البتروكيماويات: يعتبر هيدريد الإيثيل مادة خام أساسية لإنتاج الإيثيلين، وهو بمثابة الأساس للمواد البلاستيكية والراتنجات والألياف الصناعية. وهو عنصر أساسي في صناعة مادة البولي إيثيلين، وهو أحد أكثر أنواع البلاستيك استخداماً في العالم.
- الوقود والطاقة: يلعب هيدريد الإيثيل دورًا في تغذية وتشغيل عمليات صناعية محددة وهو أحد مكونات الغاز الطبيعي. تحرق الصناعات هيدريد الإيثيل لإنتاج الحرارة أو الكهرباء، وهو بمثابة مصدر للطاقة للتطبيقات السكنية والتجارية والصناعية.
- التبريد: في بعض التطبيقات، مثل أنظمة درجات الحرارة المنخفضة، يعمل هيدريد الإيثيل كمبرد، مما يوفر قدرات تبريد فعالة. إنه يوفر قدرات تبريد فعالة ويعتبر بديلاً لوسائل التبريد الأخرى ذات التأثير البيئي العالي.
- المذيب: يعمل هيدريد الإيثيل كمذيب غير قطبي، خاصة في المختبر. يسهل هيدريد الإيثيل عمليات مثل الاستخلاص والتنقية والتحليل.
- غاز المعايرة: يعمل هيدريد الإيثيل كعنصر في معايرة مخاليط الغاز لأجهزة الكشف عن الغاز وأجهزة التحليل، مما يتيح معايرة معدات الكشف عن الغاز والتحقق منها.
- دافع الهباء الجوي: يعمل هيدريد الإيثيل كمادة دافعة للأيروسول في العديد من المنتجات، حيث يقوم بطرد محتوياتها من الحاوية عند تحرير الضغط. إنه يضفي القوة اللازمة لرش المواد مثل مستحضرات التجميل والدهانات والمنتجات المنزلية.
- التخليق الكيميائي: يعمل هيدريد الإيثيل كمادة خام لتخليق مجموعة متنوعة من المواد الكيميائية العضوية، بما في ذلك الإيثانول وأكسيد الإيثيلين وكلوريد الفينيل. تجد هذه المواد الكيميائية تطبيقات في إنتاج المذيبات والبلاستيك والمنظفات وأنابيب PVC وغيرها.
تسلط هذه التطبيقات المتنوعة الضوء على أهمية هيدريد الإيثيل في العديد من الصناعات، مما يجعله عنصرًا حاسمًا في التصنيع الحديث والحياة اليومية.
أسئلة:
س: هل C2H6 قطبي أم غير قطبي؟
ج: C2H6 (هيدريد الإيثيل) هو جزيء غير قطبي لأن الفرق في السالبية الكهربية بين الكربون والهيدروجين صغير، مما يؤدي إلى توزيع موحد لكثافة الإلكترون.
س: ما عدد مولات ذرات الكربون الموجودة في 0.500 مول من C2H6؟
ج: في 0.500 مول من C2H6، يوجد 1.00 مول من ذرات الكربون، حيث أن كل جزيء من C2H6 يحتوي على ذرتين كربون.
س: ما هي الصيغة التجريبية لـ C2H6؟
ج: الصيغة التجريبية لـ C2H6 هي CH3، والتي تمثل أبسط نسبة للذرات الموجودة في الجزيء.
س: ما هو C2H6؟
ج: C2H6 هي الصيغة الكيميائية لهيدريد الإيثيل، وهو هيدروكربون غازي يستخدم عادة كوقود ومكون للغاز الطبيعي.
س: لماذا لا يحتوي الإيثان (C2H6) على أيزومرات هيكلية؟
ج: لا يحتوي هيدريد الإيثيل (C2H6) على أيزومرات هيكلية لأن ذرات الكربون فيه مرتبطة برابطة واحدة، مما يؤدي إلى بنية خطية بدون أي ترتيب آخر ممكن.
س: هل يحتوي C2H6 على رابطة هيدروجينية؟
ج: لا يحتوي C2H6 (هيدريد الإيثيل) على رابطة هيدروجينية لأنه يفتقر إلى ذرات الهيدروجين المرتبطة بعناصر عالية السالبية الكهربية مثل النيتروجين أو الأكسجين أو الفلور.
س: هل C2H6 أيوني أم تساهمي؟
ج: C2H6 مركب تساهمي لأنه يتكون من مشاركة الإلكترونات بين ذرات الكربون والهيدروجين.
س: هل C2H6 قابل للذوبان في الماء؟
ج: C2H6 غير قابل للذوبان في الماء لأنه جزيء غير قطبي ولا يذوب بسهولة في المذيب القطبي.
س: هل يحتوي خليط الغاز على CH4 وC2H6 بنسبة متساوية المولى؟
ج: نعم، إذا كان خليط الغاز يحتوي على CH4 وC2H6 بنسبة متساوية المولى، فهذا يعني أن عدد مولات CH4 يساوي عدد مولات C2H6 في الخليط.
