كربيد الكالسيوم مركب كيميائي له الصيغة CaC2. وهي تستخدم أساسا لإنتاج غاز الأسيتيلين وسياناميد الكالسيوم. يتفاعل مع الماء لينتج غاز الأسيتيلين وهيدروكسيد الكالسيوم. يستخدمه الناس في اللحام والإضاءة.
| اسم الأيوباك | إيثينيدييد الكالسيوم |
| الصيغة الجزيئية | CaC2 |
| CAS رقم | 75-20-7 |
| المرادفات | أسيتيليد الكالسيوم، بيركربون الكالسيوم، ثنائي كربيد الكالسيوم، كربوهيدرات الكالسيوم، كربوهيدرات كالسيكو، إيثينيدييد الكالسيوم |
| إنتشي | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
خصائص كربيد الكالسيوم
صيغة كربيد الكالسيوم
الصيغة الكيميائية لكربيد الكالسيوم هي CaC2. وهذا يعني أن جزيء كربيد الكالسيوم يتكون من ذرة كالسيوم واحدة وذرتين كربون. توضح الصيغة نسبة عناصر المركب.
كربيد الكالسيوم الكتلة المولية
الكتلة المولية لـ CaC2 هي 64.099 جم/مول. وهذا يعني أن كتلة المول الواحد من CaC2 تبلغ 64.099 جرامًا. يتم حساب الكتلة المولية عن طريق إضافة الكتل الذرية للعناصر الموجودة في الصيغة. تبلغ الكتلة الذرية للكالسيوم 40.078 جم / مول والكتلة الذرية للكربون 12.011 جم / مول.
نقطة غليان كربيد الكالسيوم
درجة غليان CaC2 هي 2300 درجة مئوية. وهذا يعني أن CaC2 يتغير من السائل إلى الغاز عند درجة الحرارة هذه. تتأثر نقطة الغليان بالقوى الجزيئية والضغط الجوي. يحتوي CaC2 على روابط أيونية قوية تتطلب الكثير من الطاقة لكسرها.
نقطة انصهار كربيد الكالسيوم
نقطة انصهار CaC2 هي 2160 درجة مئوية. وهذا يعني أن CaC2 يتغير من الحالة الصلبة إلى الحالة السائلة عند درجة الحرارة هذه. تتأثر نقطة الانصهار أيضًا بالقوى الجزيئية والضغط الجوي. يتمتع CaC2 بنقطة انصهار عالية بسبب روابطه الأيونية القوية.
كثافة كربيد الكالسيوم جم/مل
تبلغ كثافة CaC2 2.22 جم / مل. وهذا يعني أن المليلتر الواحد من CaC2 له كتلة 2.22 جرام. يتم حساب الكثافة عن طريق قسمة الكتلة على الحجم. تعتمد الكثافة على تكوين وترتيب الذرات أو الجزيئات في المادة. يتمتع CaC2 بكثافة عالية لأن ذراته متجمعة بإحكام في بنية بلورية.
الوزن الجزيئي لكربيد الكالسيوم
الوزن الجزيئي لـ CaC2 هو 64,099 amu (وحدات الكتلة الذرية). وهذا يعني أن كتلة جزيء CaC2 تبلغ 64,099 amu. يتم حساب الوزن الجزيئي عن طريق ضرب الكتل الذرية للعناصر الموجودة في الصيغة بعدد الذرات الخاصة بها. الكتلة الذرية للكالسيوم هي 40.078 amu والكتلة الذرية للكربون هي 12.011 amu.
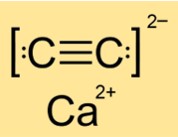
هيكل كربيد الكالسيوم
هيكل CaC2 رباعي أو أحادي الميل أو أحادي الميل اعتمادًا على الطور (I أو II أو III). وهذا يعني أن CaC2 له أشكال وترتيبات مختلفة لذراته أو جزيئاته في حالات أو ظروف مختلفة. يتم تحديد الهيكل من خلال تماثل وهندسة المادة. يحتوي CaC2 على بنية رباعية الزوايا في المرحلة الأولى، وبنية أحادية الميل في المرحلة الثانية وبنية أخرى أحادية الميل في المرحلة الثالثة.
ذوبان كربيد الكالسيوم
قابلية ذوبان CaC2 هي التحلل المائي السريع في الماء. وهذا يعني أن CaC2 يتفاعل بسرعة مع الماء ويشكل غاز الأسيتيلين وهيدروكسيد الكالسيوم كنواتج. يتم قياس الذوبان بكمية المادة التي يمكن أن تذوب في مذيب معين عند درجة حرارة وضغط معينين. وتعتمد القابلية للذوبان على طبيعة المادة والمذيب وقطبيتها، بالإضافة إلى عوامل أخرى مثل الرقم الهيدروجيني والملوحة.
| مظهر | مسحوق أبيض مع بلورات رمادية/سوداء أو مادة صلبة بلورية عديمة اللون 3 |
| كثافة محددة | 2.22 |
| لون | عديم اللون (نقي) أو رمادي/بني (الجودة التقنية) |
| يشم | عديم الرائحة (نقي) أو يشبه الثوم (الدرجة التقنية) |
| الكتلة المولية | 64,099 جم/مول |
| كثافة | 2.22 جرام/سم3 |
| نقطة الانصهار | 2160 درجة مئوية |
| نقطة الغليان | 2300 درجة مئوية |
| نقطة فلاش | 305 درجة مئوية (الأسيتيلين) |
| الذوبان في الماء | التحلل المائي السريع |
| الذوبان | غير قابلة للذوبان في الإيثانول والأثير |
| ضغط البخار | ضئيلة |
| كثافة بخار | 2.21 (الأسيتيلين) |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر كربيد الكالسيوم
CaC2 مادة كيميائية قابلة للاشتعال وخطيرة. قد يسبب خطر الحريق والانفجار عند ملامسته للماء أو الرطوبة. ويطلق غاز الأسيتيلين، وهو أيضًا قابل للاشتعال والانفجار. يمكن أن يضر CaC2 أيضًا بصحتك. هذا يمكن أن يهيج الجلد والعينين والرئتين. وهذا يمكن أن يسبب طفح جلدي، وتلف العين، والسعال، وضيق في التنفس. يمكن أن يتسبب أيضًا في تراكم السوائل في رئتيك إذا استنشقت كمية كبيرة. يجب عليك تجنب ملامسة CaC2 وارتداء معدات الحماية عند التعامل معه. يجب عليك أيضًا تخزينه في حاوية جافة مغلقة بعيدًا عن أي مصدر للاشتعال.
| رموز الخطر | F (شديد الاشتعال)، C (مسبب للتآكل)، W (يتفاعل مع الماء) |
| وصف الأمان | S2 (يحفظ بعيدًا عن متناول الأطفال)، S7/8 (تحفظ العبوة مغلقة بإحكام وجافة)، S16 (تحفظ بعيدًا عن مصادر الاشتعال)، S26 (في حالة ملامسة العينين، اشطفها فورًا بكمية كبيرة من الماء واستشر الطبيب نصيحة)، S36/37/39 (ارتداء الملابس الواقية المناسبة والقفازات وحماية العين/الوجه)، S43 (في حالة الحريق، استخدم الرمل الجاف أو المسحوق الكيميائي الجاف)، S45 (في حالة وقوع حادث أو إزعاج، اطلب الاستشارة الطبية فوراً) |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1402 |
| رمز النظام المنسق | 28491000 |
| فئة الخطر | 4.3 |
| مجموعة التعبئة | أنا |
| تسمم | الجرعة المميتة المتوسطة للجرذان عن طريق الفم: 80 ملغم/كغم، الجرعة المميتة المتوسطة للفئران عن طريق الاستنشاق: 1000 جزء في المليون/4 ساعات |
طرق تصنيع كربيد الكالسيوم
هناك طرق مختلفة لتصنيع CaC2 من مصادر الكالسيوم وأكسيد الكربون.
إحدى الطرق الأكثر شيوعًا هي طريقة فرن القوس الكهربائي. في هذه العملية، يقوم القوس الكهربائي بتسخين خليط من الجير وفحم الكوك إلى حوالي 2200 درجة مئوية. التفاعل ماص للحرارة وينتج CaC2 المنصهر وأول أكسيد الكربون. بعد الذوبان، يبرد CaC2 ويطحنه الأشخاص إلى قطع أو مسحوق، اعتمادًا على الاستخدام المقصود. تتميز هذه الطريقة باستهلاك طاقة مرتفع وتكلفة المعدات.
طريقة أخرى هي طريقة الحالة الصلبة. لتنفيذ هذه الطريقة، قم بتسخين خليط من أكسيد الكالسيوم والفحم الحيوي أو الفحم المشتق من الكتلة الحيوية في الفرن إلى حوالي 1750 درجة مئوية. يكون التفاعل صلبًا-صلبًا وينتج CaC2 الصلب وأول أكسيد الكربون. يمكنك استخدام مادة CaC2 الصلبة مباشرة أو معالجتها بشكل أكبر. تتميز هذه الطريقة باستهلاك طاقة وتكلفة معدات أقل من طريقة فرن القوس الكهربائي.
الطريقة الثالثة هي طريقة استبدال جودة طاقة فحم الكوك. ولتنفيذ هذه العملية، يتم خلط الفحم منخفض الجودة والجير ، وتشكيل الكريات، ثم يتم تحليلها حرارياً في فرن عند درجة حرارة 1000 درجة مئوية. يقوم الغاز الناتج بتوليد الكهرباء، ويتم نقل الكريات الساخنة إلى فرن CaC2 عند درجة حرارة 2000 درجة مئوية. يكون التفاعل صلبًا-صلبًا وينتج CaC2 المنصهر وأول أكسيد الكربون. بعد التبريد، يخضع CaC2 المنصهر للطحن لتكوين كتل أو مسحوق. تتمتع هذه الطريقة بكفاءة أعلى في استخدام الطاقة واستخدام الموارد مقارنة بطريقة فرن القوس الكهربائي.
استخدامات كربيد الكالسيوم
- عندما يتفاعل CaC2 مع الماء، فإنه ينتج غاز الأسيتيلين وهيدروكسيد الكالسيوم. يعتبر غاز الأسيتيلين وسيطًا مهمًا لتخليق العديد من المواد الكيميائية العضوية والبوليمرات، مثل كلوريد البولي فينيل، وأسيتات الفينيل، و1،4-بوتانيديول، وما إلى ذلك. هيدروكسيد الكالسيوم مركب متعدد الاستخدامات وله استخدامات متعددة.
- لإنتاج سياناميد الكالسيوم، يتفاعل البشر CaC2 مع النيتروجين عند درجات حرارة عالية. يعمل سياناميد الكالسيوم كسماد نيتروجيني ومبيدات أعشاب ومزيل للأوراق.
- لتقليل محتوى الكبريت من الحديد والحديد الزهر والحديد الزهر والصلب، يتم استخدام CaC2. يتفاعل هذا المركب الكيميائي مع الكبريت لتكوين كبريتيد الكالسيوم، مما يؤدي إلى إزالة الكبريت من المعدن بشكل فعال. تعمل هذه العملية على تحسين جودة وليونة منتجات الصلب.
- تستخدم مصابيح الكربيد CaC2 لإنتاج غاز الأسيتيلين الذي يولد الضوء عند احتراقه. كانت هذه المصابيح شائعة في صناعات التعدين والكهوف وركوب الدراجات والسيارات قبل أن تصبح المصابيح الكهربائية شائعة.
- يستخدم الناس CaC2 كعامل إنضاج في الفواكه مثل الموز والمانجو والبابايا. يطلق غاز الإيثيلين الذي يسرع عملية النضج ويعزز لون وحلاوة الفاكهة. تعتبر العديد من البلدان ممارسة استخدام بقايا CaC2 لإنضاج الثمار غير قانونية وضارة بسبب المخاطر الصحية المرتبطة بها.
- يستخدم الناس CaC2 في مدافع الخيزران ومدافع الانفجار الكبير لإصدار أصوات عالية. عند مزجه بالماء ينتج غاز الأسيتيلين الذي يشتعل ليخلق تجربة ممتعة واحتفالية للجميع.
- يستخدم أيضًا كمزيل للأكسدة في صناعة الصلب. فهو يزيل الأكسجين من الفولاذ المنصهر ويمنع تكوين الأكاسيد التي يمكن أن تؤثر على جودة منتجات الفولاذ.
أسئلة:
س: أين يمكن شراء كربيد الكالسيوم محليا؟
ج: قد تتمكن من العثور على كميات صغيرة من CaC2 في منطقتك في بعض متاجر الأجهزة أو مستلزمات اللحام. ومع ذلك، إذا كنت بحاجة إلى كميات كبيرة من CaC2، فقد يكون من الأفضل استيراده مباشرة من الشركات المصنعة. يمكنك الاتصال ببعض الموردين عبر الإنترنت.
س: كيفية إزالة كربيد الكالسيوم؟
ج: يعتبر CaC2 من النفايات الخطرة ويجب التخلص منها بشكل صحيح. يجب ألا ترميه في سلة المهملات أو في البالوعة، لأنه يمكن أن يتفاعل مع الماء وينتج غاز الأسيتيلين، وهو غاز قابل للاشتعال والانفجار. يجب عليك الاتصال بهيئة النفايات الخطرة المحلية أو شركة التخلص من النفايات المرخصة للحصول على المشورة بشأن كيفية التخلص من CaC2 بشكل آمن. قد يلزم تحييده بالماء في منطقة جيدة التهوية ثم تعبئته في حاوية مغلقة للنقل.
س: ما الذي يتشكل عند تفاعل كربيد الكالسيوم مع الماء الثقيل؟
ج: الماء الثقيل هو الماء الذي يحتوي على الديوتيريوم بدلاً من الهيدروجين. الديوتيريوم هو نظير للهيدروجين يحتوي على بروتون واحد ونيوترون واحد في نواته. عندما يتفاعل CaC2 مع الماء الثقيل، فإنه يشكل هيدروكسيد الكالسيوم والأسيتيلين المخفف. الأسيتيلين الديوتريوم هو الأسيتيلين الذي يحتوي على الديوتيريوم بدلاً من الهيدروجين. المعادلة الكيميائية لهذا التفاعل هي:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
س: هل كربيد الكالسيوم خطير؟
ج: نعم، CaC2 خطير ويجب التعامل معه بحذر. يمكن أن يسبب مخاطر الحريق والانفجار عندما يتلامس مع الماء أو الرطوبة، لأنه يطلق غاز الأسيتيلين، وهو أيضًا قابل للاشتعال والانفجار. يمكن أن يضر أيضًا بصحتك لأنه يمكن أن يهيج الجلد والعينين والرئتين. يمكن أن يسبب CaC2 طفح جلدي، وتلف العين، والسعال، وضيق التنفس. يمكن أن يتسبب أيضًا في تراكم السوائل في رئتيك إذا استنشقت كمية كبيرة. يجب عليك تجنب ملامسة CaC2 وارتداء معدات الحماية عند التعامل معه. يجب عليك أيضًا تخزينه في حاوية جافة مغلقة بعيدًا عن أي مصدر للاشتعال.
س: هل كربيد الكالسيوم أيوني أم تساهمي؟
ج: CaC2 مركب أيوني. وتتكون من أيونات الكالسيوم (Ca2+) وأيونات الكربيد (C22-). تتشكل المركبات الأيونية عندما تفقد ذرات المعدن الإلكترونات وتكتسب الذرات اللافلزية إلكترونات لتحقيق تكوينات إلكترونية مستقرة. يتم تثبيت الأيونات الناتجة معًا بواسطة قوى الجذب الكهروستاتيكية. يحتوي CaC2 على روابط أيونية قوية تتطلب الكثير من الطاقة لكسرها.
س: كيف يتم تصنيع كربيد الكالسيوم؟
ج: يتم الحصول على CaC2 عن طريق تسخين خليط من الجير (أكسيد الكالسيوم) وفحم الكوك (الكربون) إلى حوالي 2200 درجة مئوية في فرن القوس الكهربائي. التفاعل ماص للحرارة وينتج CaC2 المنصهر وأول أكسيد الكربون. يتم بعد ذلك تبريد CaC2 المنصهر وطحنه إلى قطع أو مسحوق. تتميز هذه الطريقة باستهلاك طاقة مرتفع وتكلفة المعدات. هناك أيضًا طرق أخرى تستخدم مصادر كربون مختلفة، مثل الفحم الحيوي أو الفحم منخفض الرتبة، وطرق تسخين مختلفة، مثل التسخين بالحالة الصلبة أو التسخين بالحث. يمكن أن يكون لهذه الطرق استهلاك طاقة وتكلفة معدات أقل من طريقة فرن القوس الكهربائي.
س: هل يمكنني تحويل كربونات الكالسيوم إلى كربيد الكالسيوم؟
ج: لا، لا يمكنك تحويل كربونات الكالسيوم مباشرة إلى CaC2. كربونات الكالسيوم مركب مستقر لا يتفاعل مع الكربون عند درجات الحرارة العالية. يجب أولاً تحويل كربونات الكالسيوم إلى أكسيد الكالسيوم عن طريق تسخينه بقوة في غياب الهواء (التكليس). ثم يمكنك تفاعل أكسيد الكالسيوم مع الكربون عند درجات حرارة عالية لإنتاج CaC2 (الكربنة). المعادلة الكيميائية الشاملة لهذه العملية هي:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
س: ما صحة التفاعل التالي؟ Ca(s) + 2C(s) -> CaC2(s) + 62.8 كيلوجول
ج: العبارات التالية صحيحة بالنسبة لرد الفعل:
- هو تفاعل اصطناعي يتم فيه اتحاد عنصرين أو أكثر لتكوين مركب.
- هذا هو رد فعل طارد للحرارة، حيث يتم إطلاق الحرارة في البيئة.
- هذا هو تفاعل الأكسدة والاختزال، حيث يتم أكسدة الكالسيوم وتقليل الكربون.
- هذا هو التفاعل العكسي لتكوين CaC2 من أكسيد الكالسيوم والكربون.
س: ما هي الحرارة القياسية لتكوين cac2(s)؟
ج: الحرارة القياسية لتكوين cac2(s) هي التغير في المحتوى الحراري عندما يتكون مول واحد من CaC2 من عناصره في حالاتها القياسية عند 25 درجة مئوية و1 atm. ويمكن حسابه من المعادلات الكيميائية الحرارية المعطاة باستخدام قانون هيس. المعادلة الشاملة لتكوين CaC2 هي:
Ca(s) + 2C(s) -> CaC2(s)
وباستخدام قانون هيس يمكننا أن نكتب:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414.79 كيلوجول + 65.19 كيلوجول + 462.30 كيلوجول – 221.00 كيلوجول – 571.80 كيلوجول = -680.10 كيلوجول
ولذلك، فإن الحرارة القياسية لتكوين cac2(s) هي -680.10 كيلوجول/مول.
س: ما هو عدد جرامات cac2 اللازمة لتوليد 0.35 مول من hcch(g)؟
ج: للإجابة على هذا السؤال، علينا استخدام المعادلة الموزونة للتفاعل بين CaC2 والماء:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
من هذه المعادلة يمكننا أن نرى أن مولًا واحدًا من cac2 ينتج مولًا واحدًا من hcch (يُسمى أيضًا الأسيتيلين). ولذلك، لتوليد 0.35 مول من hcch، نحتاج إلى 0.35 مول من cac2. للتحويل من المولات إلى الجرام، نحتاج إلى استخدام الكتلة المولية لـ cac2، وهي 64.099 جم/مول. وبضرب المولات في الكتلة المولية نحصل على:
0.35 مول × 64.099 جم/مول = 22.435 جم
لذلك، نحتاج إلى 22.435 جرامًا من cac2 لتوليد 0.35 مولًا من hchch.
س: ما عدد مولات cac2 اللازمة للتفاعل الكامل مع 49.0 جم من الماء؟
ج: للإجابة على هذا السؤال علينا استخدام المعادلة الموزونة للتفاعل بين كربيد الكالسيوم والماء:
CaC2(s) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
من هذه المعادلة يمكننا أن نرى أن مول واحد من cac2 يتفاعل مع مولين من الماء. لذلك، للعثور على مولات cac2 اللازمة، نحتاج إلى تقسيم مولات h2o على اثنين. للتحويل من الجرام إلى المولات، علينا استخدام الكتلة المولية للماء، وهي 18.015 جم/مول. وبقسمة الجرام على الكتلة المولية نحصل على:
49.0 جم / 18.015 جم/مول = 2.72 مول
وتقسيم هذا على اثنين يعطي:
2.72 مول / 2 = 1.36 مول
لذلك، نحتاج إلى 1.36 مولًا من cac2 للتفاعل تمامًا مع 49.0 جم من الماء.
س: ما هي نواتج التفاعل بين كربيد الكالسيوم والماء؟
ج: نواتج التفاعل بين CaC2 والماء هي غاز الأسيتيلين ومحلول هيدروكسيد الكالسيوم.
