ثنائي إيثيل أمين (DEA) هو مركب كيميائي له رائحة قوية تشبه رائحة الأمونيا. يتم استخدامه في إنتاج المبيدات الحشرية والأدوية ومسرعات المطاط. وهذا قد يسبب تهيج الجلد والعينين والجهاز التنفسي.
| اسم الأيوباك | N، N- ثنائي إيثيل ميثانامين |
| الصيغة الجزيئية | C4H11N |
| CAS رقم | 109-89-7 |
| المرادفات | ن- إيثيل إيثانامين، DEA، ثنائي إيثيل أمينو، N، N- ثنائي إيثيل أمين، ن- إيثيل ثانامين، ثنائي إيثيل أمين |
خصائص ثنائي إيثيل أمين
صيغة ثنائي إيثيل أمين
صيغة ثنائي إيثيل أمين هي C4H11N. وهو أمين أليفاتي أساسي يحتوي على مجموعتي إيثيل مرتبطتين بذرة النيتروجين. يحتوي التركيب الجزيئي لثنائي إيثيل أمين على ذرة نيتروجين مركزية مرتبطة بمجموعتي إيثيل وذرة هيدروجين.
ثنائي إيثيل أمين الكتلة المولية
الكتلة المولية لـ DEA هي 73.14 جم / مول. يتم حساب ذلك عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في جزيء DEA. الكتلة المولية هي معلمة مهمة تستخدم لحساب كمية DEA اللازمة لتفاعل كيميائي معين.
نقطة غليان ثنائي إيثيل أمين
درجة غليان DEA هي 55.8 درجة مئوية. وهذا يعني أنه عند درجة الحرارة هذه، سيبدأ الشكل السائل لـ DEA بالتبخر والتحول إلى غاز. تعتبر نقطة الغليان معلمة مهمة تحدد الشروط المطلوبة لحدوث التفاعل الكيميائي.
نقطة انصهار ثنائي إيثيل أمين
نقطة انصهار DEA هي -49.8 درجة مئوية. وهذا يعني أنه عند درجة الحرارة هذه، سيبدأ الشكل الصلب لـ DEA في الذوبان والتحول إلى سائل. تعتبر نقطة الانصهار معلمة مهمة تستخدم لتحديد نقاء DEA.
كثافة ثنائي إيثيل أمين جم / مل
كثافة DEA هي 0.707 جم / مل. وهذا يعني أن الملليلتر الواحد من DEA يزن 0.707 جرام. تعد الكثافة معلمة مهمة تستخدم لحساب كمية DEA اللازمة لتفاعل كيميائي معين.
الوزن الجزيئي ثنائي إيثيل أمين
الوزن الجزيئي لـ DEA هو 73.14 جم / مول. إنه مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء DEA. يعد الوزن الجزيئي معلمة مهمة تستخدم لحساب كمية DEA المطلوبة لتفاعل كيميائي معين.
هيكل ثنائي إيثيل أمين
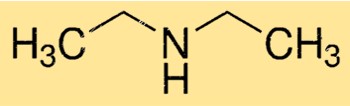
يمتلك DEA بنية جزيئية خطية، حيث ترتبط ذرة النيتروجين المركزية بمجموعتي إيثيل وذرة هيدروجين. يمتلك الجزيء شكل هرم ثلاثي بسبب وجود زوج من الإلكترونات الوحيدة الموجودة على ذرة النيتروجين. هذا الهيكل مهم في تحديد تفاعل وخصائص DEA.
ذوبان ثنائي إيثيل أمين
DEA قابل للذوبان في الماء والعديد من المذيبات العضوية. قيمة pKa لها هي 10.75، مما يعني أنها قاعدة ضعيفة. تعتمد قابلية ذوبان DEA على عوامل مثل درجة الحرارة ودرجة الحموضة وقطبية المذيب. ذوبانه في الماء هو 100 جم / لتر عند 25 درجة مئوية.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.707 جم/مل |
| لون | عديم اللون |
| يشم | تشبه الأمونيا |
| الكتلة المولية | 73.14 جرام/مول |
| كثافة | 0.707 جم/مل |
| نقطة الانصهار | -49.8 درجة مئوية |
| نقطة الغليان | 55.8 درجة مئوية |
| نقطة فلاش | -15 درجة مئوية |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في العديد من المذيبات العضوية |
| ضغط البخار | 94.7 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 2.5 |
| pKa | 10:75 صباحًا |
| الرقم الهيدروجيني | أساسي |
سلامة ومخاطر ثنائي إيثيلامين
يمكن أن يكون DEA خطيرًا على صحة الإنسان إذا لم يتم التعامل معه بشكل صحيح. وهو مادة أكالة وقد يسبب تهيج الجلد والعينين والجهاز التنفسي عند ملامسته. التعرض لفترات طويلة لـ DEA يمكن أن يسبب تلف الكبد والكلى. وهو قابل للاشتعال ويمكن أن يشكل مخاليط متفجرة مع الهواء. ينبغي اتخاذ احتياطات خاصة مثل التهوية الكافية ومعدات الحماية الشخصية وحاويات التخزين المقاومة للحريق عند التعامل مع AED. وفي حالة التعرض العرضي، يجب طلب العناية الطبية الفورية. من المهم اتباع جميع إرشادات وبروتوكولات السلامة عند العمل مع DEA للحفاظ على سلامتك وسلامة الآخرين.
| رموز الخطر | تآكل، قابلة للاشتعال |
| وصف الأمان | الابتعاد عن الحرارة والشرر واللهب المكشوف والأسطح الساخنة. تجنب استنشاق الأبخرة أو الضباب أو الغازات. ارتداء القفازات الواقية وحماية العين وحماية الوجه. استخدام في منطقة جيدة التهوية. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1154 |
| رمز النظام المنسق | 29211990 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب تهيج الجلد والعينين والجهاز التنفسي. التعرض لفترات طويلة قد يسبب تلف الكبد والكلى. |
طرق تخليق ثنائي إيثيل أمين
هناك عدة طرق لتصنيع DEA، بما في ذلك تفاعل الإيثانول والأمونيا أو تفاعل ثنائي إيثيل كبريتات والأمونيا.
تتضمن إحدى الطرق تسخين خليط من الإيثانول والأمونيا في وجود محفز، مثل الألومينا أو هلام السيليكا. وينتج عن التفاعل DEA وماء، يمكن فصلهما عن طريق التقطير.
هناك طريقة أخرى تتضمن تفاعل كبريتات ثنائي إيثيل مع الأمونيا . يحدث التفاعل في مذيب، مثل الميثانول أو الإيثانول، وينتج كبريتات DEA. لإنتاج DEA وكبريتات الصوديوم، يمكن معالجة كبريتات DEA بقاعدة قوية، مثل هيدروكسيد الصوديوم.
لتصنيع DEA، يمكن تفاعل الإيثيلين مع الأمونيا في وجود محفز، مثل أكسيد الحديد. ينتج عن التفاعل خليط من DEA وثلاثي إيثيل أمين، والذي يمكن فصله عن طريق التقطير.
عند تصنيع DEA، يجب توخي الحذر لأن الكواشف والمنتجات قد تشكل مخاطر على صحة الإنسان والبيئة. ولذلك، فمن الضروري استخدام تدابير السلامة والمعدات المناسبة أثناء عملية التوليف.
استخدامات ثنائي إيثيل أمين
لدى DEA عدة استخدامات في صناعات مختلفة نظرًا لخصائصه الفريدة. فيما يلي بعض استخداماته الشائعة:
- المستحضرات الصيدلانية: تستخدم كمادة أساسية في تركيب الأدوية مثل أدوية التخدير الموضعي ومضادات الهيستامين.
- المواد الكيميائية الزراعية: تستخدم كمادة خام في إنتاج مبيدات الأعشاب، مثل الغليفوسات.
- صناعة المطاط: يستخدم في إنتاج مسرعات تقسية المطاط.
- صناعة الأصباغ: تستخدم في إنتاج الأصباغ والصبغات، مثل الأصباغ الحمضية والأصباغ التفاعلية.
- مثبطات التآكل: تستخدم كمثبطات للتآكل في صناعة البترول لحماية خطوط الأنابيب وصهاريج التخزين من التآكل.
- المذيبات: تستخدم كمذيب في إنتاج الراتنجات والبوليمرات الاصطناعية.
- التخليق الكيميائي: يستخدم أيضًا ككاشف في مجموعة واسعة من تفاعلات التخليق الكيميائي.
أسئلة:
س: أيهما أكثر أساسية ثلاثي إيثيل أمين أم ثنائي إيثيل أمين؟
ج: يعتبر ثلاثي إيثيل أمين أكثر قاعدية من DEA نظرًا لحجمه الأكبر ووجود ثلاث مجموعات إيثيل تساعد على زيادة كثافة الإلكترون.
س: ما هو الرقم الهيدروجيني لـ 0.10 M ثنائي إيثيل أمين، (CH3CH2)2NH، (Kb = 8.6 × 10−4)؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول DEA 0.10 M باستخدام قيمة Kb ومعادلة ثابت التفكك الأساسي. الرقم الهيدروجيني للمحلول هو حوالي 10.49.
س: ما هو الرقم الهيدروجيني لـ 0.11 M ثنائي إيثيل أمين، (CH3CH2)2NH، (Kb = 8.6 × 10−4)؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول DEA 0.11 M باستخدام قيمة Kb ومعادلة ثابت التفكك الأساسي. الرقم الهيدروجيني للمحلول هو حوالي 10.50.
س: ما هو المحتوى الحراري القياسي لتكوين ثنائي إيثيل أمين السائل (CH3CH2)2NH؟
ج: المحتوى الحراري القياسي لتكوين DEA السائل هو -42.52 كيلوجول/مول.
س: هل ثنائي إيثيل أمين قطبي؟
ج: نعم، DEA قطبي بسبب وجود ذرة النيتروجين مع زوج من الإلكترونات الوحيدة والفرق في السالبية الكهربية بين النيتروجين والكربون.
س: أيهما أكثر أساسية ثنائي إيثيل أمين أم ثلاثي إيثيل أمين؟
ج: يعتبر ثلاثي إيثيل أمين أكثر قاعدية من DEA بسبب وجود ثلاث مجموعات إيثيل تساعد على زيادة كثافة الإلكترون.
س: ما هو الرقم الهيدروجيني لمحلول ثنائي إيثيل أمين 0.10 م؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول DEA 0.10 M باستخدام قيمة Kb ومعادلة ثابت التفكك الأساسي. الرقم الهيدروجيني للمحلول هو حوالي 10.49.
س: هل ثنائي إيثيل أمين حمض قوي أم ضعيف؟
ج: DEA قاعدة ضعيفة وليست حمضًا قويًا. يتفاعل مع الماء لإنتاج أيونات الهيدروكسيد وأيونات ثنائي إيثيل الأمونيوم.
