بيركلورات الصوديوم مركب كيميائي له الصيغة NaClO4. وهي مادة صلبة بلورية بيضاء شديدة الذوبان في الماء وتستخدم عادة كعامل مؤكسد في العمليات الصناعية المختلفة.
| اسم الأيوباك | بيركلورات الصوديوم |
| الصيغة الجزيئية | كلوريد الصوديوم4 |
| CAS رقم | 7601-89-0 |
| المرادفات | حمض البيركلوريك، ملح الصوديوم؛ بيركلورات الصوديوم (الفرنسية)؛ بيركلورات الصوديوم (الألمانية)؛ بيركلوراتو دي سوديو (الإيطالية)؛ بيركلوراتو سوديكو (الإسبانية)؛ الأمم المتحدة 1502 |
| إنتشي | InChI=1S/ClHO4.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
خصائص بيركلورات الصوديوم
صيغة بيركلورات الصوديوم
الصيغة الكيميائية لبيركلورات الصوديوم هي NaClO4. وهذا يعني أن المركب يتكون من ذرة صوديوم واحدة، وذرة كلور واحدة، وأربع ذرات أكسجين. بيركلورات الصوديوم هو عامل مؤكسد قوي يستخدم عادة في العمليات الصناعية المختلفة.
بيركلورات الصوديوم الكتلة المولية
الكتلة المولية لـ NaClO4 هي 122.44 جم/مول. وهذا يعني أن المول الواحد من NaClO4 يحتوي على 122.44 جرامًا من المركب. تعتبر الكتلة المولية للمركب مهمة في تحديد كمية المادة اللازمة للتفاعل الكيميائي.
نقطة غليان بيركلورات الصوديوم
نقطة غليان NaClO4 هي 545 درجة مئوية (1013 hPa). هذه هي درجة الحرارة التي يتحول عندها المركب من سائل إلى غاز. يتمتع NaClO4 بنقطة غليان عالية بسبب القوى الكهروستاتيكية القوية بين أيونات الصوديوم والبيركلورات.
نقطة انصهار بيركلورات الصوديوم
نقطة انصهار NaClO4 هي 482 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب من الحالة الصلبة إلى الحالة السائلة. يتمتع NaClO4 بنقطة انصهار عالية بسبب القوى الكهروستاتيكية القوية بين أيونات الصوديوم والبيركلورات.
كثافة بيركلورات الصوديوم جم/مل
تبلغ كثافة NaClO4 2.52 جم/مل. وهذا يعني أن الملليلتر الواحد من NaClO4 يزن 2.52 جرام. كثافة المادة مهمة في تحديد خواصها الفيزيائية، مثل الطفو واللزوجة.
الوزن الجزيئي لبيركلورات الصوديوم
الوزن الجزيئي لـ NaClO4 هو 122.44 جم/مول. هذا هو مجموع الأوزان الذرية لذرات الصوديوم والكلور والأكسجين في المركب. الوزن الجزيئي للمركب مهم في تحديد خواصه الفيزيائية والكيميائية.
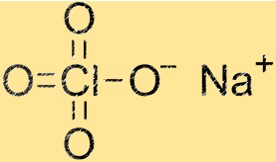
هيكل بيركلورات الصوديوم
هيكل NaClO4 عبارة عن شبكة بلورية تتكون من كاتيونات Na+ وأنيونات ClO4-. كاتيونات الصوديوم محاطة بأربع ذرات أكسجين، بينما تتكون أنيونات ClO4- من ذرة كلور واحدة وأربع ذرات أكسجين. يعطي هيكل الشبكة البلورية NaClO4 خواصه الفيزيائية والكيميائية المميزة.
ذوبان بيركلورات الصوديوم
NaClO4 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ 209 جم / 100 مل عند 20 درجة مئوية. وهذا يعني أن كمية كبيرة من NaClO4 يمكن أن تذوب في كمية صغيرة من الماء. إن قابلية ذوبان NaClO4 العالية تجعله مفيدًا في العمليات الصناعية المختلفة، مثل إنتاج بيركلورات الأمونيوم لوقود الصواريخ.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.52 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 122.44 جرام/مول |
| كثافة | 2.52 جم/مل |
| نقطة الانصهار | 482 درجة مئوية |
| نقطة الغليان | 545 درجة مئوية (1013hPa) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 209 جم/100 مل عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الماء والإيثانول |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | غير متاح |
سلامة ومخاطر بيركلورات الصوديوم
NaClO4 مركب خطير يجب التعامل معه بحذر. وهو عامل مؤكسد قوي يمكن أن يتفاعل بعنف مع المواد العضوية وعوامل الاختزال والمواد الكيميائية الأخرى. قد يؤدي التعرض لغبار أو بخار NaClO4 إلى تهيج العينين والجلد والجهاز التنفسي. قد يؤدي تناول NaClO4 إلى تهيج الجهاز الهضمي والغثيان والقيء. كما أن NaClO4 ضار بالحياة المائية ويجب التخلص منه بشكل صحيح. يجب ارتداء معدات الحماية الشخصية مثل القفازات والنظارات الواقية وجهاز التنفس عند التعامل مع NaClO4 لتجنب التعرض. تعتبر التهوية والتخزين المناسبين أمرًا مهمًا أيضًا لتقليل مخاطر الحوادث.
| رموز الخطر | يا، اكس.ن |
| وصف الأمان | لا تتنفس الغبار / الأبخرة / الغاز / الضباب / الأبخرة / الرذاذ. ارتداء القفازات الواقية / الملابس الواقية / حماية العين / حماية الوجه. في حالة الاستنشاق: أخرج الضحية إلى الهواء النقي وابقها في وضع مريح للتنفس. إذا ابتلع: اشطف الفم. لا تقم بتحريض القيء. اتصل بمركز السموم أو الطبيب إذا شعرت بتوعك. |
| أرقام تعريف الأمم المتحدة | UN1502 |
| رمز النظام المنسق | 2829.90.90 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | سام إذا ابتلع، ضار إذا تم استنشاقه أو ملامسته للجلد. قد يسبب تهيج أو تآكل. |
طرق تصنيع بيركلورات الصوديوم
يمكن لطرق مختلفة تصنيع NaClO4.
تتضمن الطريقة الشائعة تفاعل كلورات الصوديوم مع حمض الهيدروكلوريك ، مما يؤدي إلى تكوين NaClO4 وكلوريد الصوديوم .
هناك طريقة أخرى تتضمن التحليل الكهربائي لمحلول كلوريد الصوديوم في وجود ملح بيركلورات. ويحدث تحويل كلوريد الصوديوم إلى كلورات الصوديوم، يليه إضافة حمض الهيدروكلوريك الذي يحوله إلى NaClO4.
هناك طريقة أخرى تتمثل في تفاعل كلورات الصوديوم مع كلوريد الصوديوم في وجود حمض الكبريتيك. تنتج هذه الطريقة خليطًا من NaClO4 وكبريتات الصوديوم، والذي يمكن فصله عن طريق التبلور التجزيئي.
تتضمن الطريقة الأخرى تفاعل كلورات الصوديوم مع بيركلورات الأمونيوم، مما ينتج عنه NaClO4 وكلوريد الأمونيوم. إنتاج NaClO4، الذي يستخدم عادة كعامل مؤكسد في الوقود الصاروخي الصلب، ينطوي على استخدام هذه الطريقة.
تفاعل هيبوكلوريت الصوديوم مع كلورات الصوديوم في وجود حمض الهيدروكلوريك يؤدي أيضًا إلى تصنيع NaClO4. تنتج هذه الطريقة NaClO4 وكلوريد الصوديوم كمنتجين رئيسيين.
استخدامات بيركلورات الصوديوم
NaClO4 له استخدامات مختلفة في الصناعات المختلفة. فيما يلي بعض التطبيقات الشائعة لـ NaClO4:
- الوقود الدافع للصواريخ: يشيع استخدامه كمؤكسدات في الوقود الصاروخي الصلب بسبب محتواه العالي من الأكسجين وثباته العالي.
- الألعاب النارية: تستخدم كمؤكسد في تركيبات الألعاب النارية مثل المشاعل والألعاب النارية والمشاعل.
- الكيمياء التحليلية: تستخدم كمصدر لأيونات البيركلورات في الكيمياء التحليلية لتقدير الأيونات في العينات المختلفة.
- الطلاء الكهربائي: يستخدم كعنصر في محاليل الطلاء الكهربائي لتحسين توصيل واستقرار حمام الطلاء.
- البطاريات: تستخدم كإلكتروليت في بطاريات الليثيوم أيون، وذلك بسبب قابليتها العالية للذوبان وقدرتها على تحسين الخواص الكهروكيميائية للبطارية.
- التطبيقات الطبية: يستخدم في علاج اضطرابات الغدة الدرقية كمثبط تنافسي لنقل اليود. يستخدم أيضًا في إنتاج عوامل التباين للتصوير الطبي.
- معالجة المياه: يستخدم في معالجة المياه كمطهر ولإزالة بعض الملوثات من المياه.
أسئلة:
س: ما هي صيغة بيركلورات الصوديوم؟
ج: NaClO4.
س: هل بيركلورات الصوديوم قابلة للذوبان في الماء؟
ج: نعم، NaClO4 عالي الذوبان في الماء.
س: هل بيركلورات الصوديوم حمض أم قاعدة؟
ج: NaClO4 ليس حمضاً ولا قاعدة. إنه ملح.
س: ما هو تفاعل بيركلورات الأمونيوم وبروميد الصوديوم؟
ج: التفاعل هو: NH4ClO4 + NaBr → NaClO4 + NH4Br.
س: ما عدد أيونات الصوديوم الموجودة في بيركلورات الصوديوم؟
ج: يوجد أيون الصوديوم في NaClO4.
س: هل NaClO4 حمض أم قاعدة؟
ج: NaClO4 ليس حمضاً ولا قاعدة. إنه ملح.
س: ما هي الأنواع المذابة الموجودة في محلول NaClO4؟
ج: في محلول NaClO4، الأنواع المذابة هي Na+ وClO4- أيونات.
س: ما عدد مولات الأكسجين الموجودة في 3.30 مول من NaClO4؟
ج: يوجد 13.2 مول من الأكسجين في 3.30 مول من NaClO4.
س: هل NaClO4 قابل للذوبان في الماء؟
ج: نعم، NaClO4 شديد الذوبان في الماء.
س: ما عدد مولات الأكسجين الموجودة في 1.10 مول من NaClO4؟
ج: يوجد 4.4 مول من الأكسجين في 1.10 مول من NaClO4.
