هيبوكلوريت البوتاسيوم (KClO) هو مركب كيميائي يستخدم عادة كمطهر ومبيض. لها رائحة قوية ويمكن أن تكون خطيرة إذا لم يتم التعامل معها بشكل صحيح.
| اسم الأيوباك | هيبوكلوريت البوتاسيوم |
| الصيغة الجزيئية | بوكلو |
| CAS رقم | 7778-66-7 |
| المرادفات | حمض هيبوكلوروس، ملح البوتاسيوم؛ أوكسي كلوريد البوتاسيوم؛ كلورات البوتاسيوم (I) |
| إنتشي | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
خصائص هيبوكلوريت البوتاسيوم
صيغة هيبوكلوريت البوتاسيوم
الصيغة الكيميائية لهيبوكلوريت البوتاسيوم هي KClO. ويتكون من أيون البوتاسيوم وذرة الكلور وذرة الأكسجين. هيبوكلوريت البوتاسيوم مادة صلبة بيضاء اللون في درجة حرارة الغرفة ولها رائحة كلور قوية. يستخدم عادة كمطهر ومبيض في مختلف الصناعات.
هيبوكلوريت البوتاسيوم الكتلة المولية
الكتلة المولية لـ KClO هي 90.55 جم/مول. وهو مجموع الكتل الذرية للعناصر المكونة للبوتاسيوم والكلور والأكسجين. الكتلة المولية هي معلمة مهمة تستخدم في قياس العناصر الكيميائية والحسابات الكيميائية الأخرى.
نقطة غليان هيبوكلوريت البوتاسيوم
يتحلل KClO قبل أن يصل إلى نقطة الغليان. ولذلك فإن نقطة الغليان ليست محددة بشكل جيد. عند تسخينه، فإنه يتحلل إلى كلوريد البوتاسيوم وغاز الأكسجين. يعد تحلل KClO تفاعلًا طاردًا للحرارة ويمكن أن يكون خطيرًا إذا لم يتم التعامل معه بشكل صحيح.
نقطة انصهار هيبوكلوريت البوتاسيوم
نقطة انصهار KClO هي 100 إلى 102 درجة مئوية. وهي مادة صلبة بيضاء في درجة حرارة الغرفة وتذوب عند تسخينها. تعتبر نقطة الانصهار خاصية فيزيائية مهمة للمادة وتستخدم لتحديد وتوصيف المادة.
كثافة هيبوكلوريت البوتاسيوم جم/مل
تبلغ كثافة KClO 2.35 جم/مل. وهذا يعني أن الملليلتر الواحد من KClO يزن 2.35 جرام. الكثافة هي مقياس للكتلة لكل وحدة حجم من المادة وهي معلمة مهمة في الحسابات الكيميائية.
الوزن الجزيئي هيبوكلوريت البوتاسيوم
الوزن الجزيئي لـ KClO هو 90.55 جم / مول. إنه مجموع الأوزان الذرية للعناصر المكونة لجزيء KClO. يستخدم الوزن الجزيئي في الحسابات الكيميائية مثل تحديد الكتلة المولية وقياس العناصر الكيميائية.
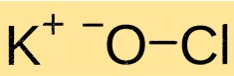
هيكل هيبوكلوريت البوتاسيوم
KClO له بنية بلورية. وهي مكونة من كاتيونات K+ وأنيونات ClO مرتبطة ببعضها البعض بواسطة روابط أيونية. يشبه هيكل KClO هيكل المركبات الأيونية الأخرى ويتم تحديده من خلال شحنة وحجم الأيونات المكونة.
ذوبان هيبوكلوريت البوتاسيوم
KClO شديد الذوبان في الماء. وهو يشكل محلولاً من كاتيونات K+ وأنيونات ClO- عندما يذوب في الماء. تتأثر ذوبان KClO في الماء بدرجة الحرارة ودرجة الحموضة. تزيد درجات الحرارة المرتفعة وقيم الأس الهيدروجيني المنخفضة من قابلية ذوبان KClO في الماء.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 2.35 |
| لون | أبيض |
| يشم | رائحة الكلور قوية |
| الكتلة المولية | 90.55 جرام/مول |
| كثافة | 2.35 جرام/مل |
| نقطة الانصهار | 100-102 درجة مئوية |
| نقطة الغليان | يتحلل قبل نقطة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | يذوب في الماء |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | القلوية (الرقم الهيدروجيني 11-13) |
سلامة ومخاطر هيبوكلوريت البوتاسيوم
يمكن أن يكون KClO خطيرًا إذا لم يتم التعامل معه بشكل صحيح. وهو عامل مؤكسد قوي يمكنه التفاعل مع المواد العضوية لإنتاج مركبات خطرة. يعد KClO أيضًا مهيجًا قويًا للجلد والعينين والجهاز التنفسي. التلامس المباشر مع الجلد قد يسبب حروقًا وتهيجًا. قد يسبب استنشاق أبخرة KClO السعال والصفير وضيق التنفس. وينبغي التعامل مع المركب في منطقة جيدة التهوية، مع معدات الحماية الشخصية المناسبة مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي. وفي حالة التعرض العرضي، يجب طلب العناية الطبية الفورية.
| رموز الخطر | مؤكسد |
| وصف الأمان | ارتداء القفازات وحماية العين/الوجه. الابتعاد عن المواد القابلة للاحتراق. تجنب ملامسة الجلد والعينين. |
| أرقام تعريف الأمم المتحدة | UN1748 |
| رمز النظام المنسق | 2828.90.10 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد تكون ضارة إذا ما ابتلع. يسبب حروقا جلدية شديدة وتلفا للعين. قد يسبب تهيج الجهاز التنفسي. |
طرق تصنيع هيبوكلوريت البوتاسيوم
توجد طرق مختلفة لتصنيع هيبوكلوريت البوتاسيوم.
إحدى الطرق الشائعة هي تفاعل غاز الكلور مع محلول هيدروكسيد البوتاسيوم . ينتج عن التفاعل KClO وكلوريد البوتاسيوم كمنتجات ثانوية:
Cl2 + 2KOH → بوكل + KClO + H2O
طريقة أخرى تتضمن تفاعل هيبوكلوريت الكالسيوم مع كلوريد البوتاسيوم . ينتج عن هذا التفاعل KClO وكلوريد الكالسيوم كمنتجات ثانوية:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
لتصنيع KClO، يمكن تفاعل حمض هيبوكلوروس مع هيدروكسيد البوتاسيوم .
2 كوه + حمض الهيدروكلوريك → KClO + بوكل + H2O
لإنتاج KClO، يمكن استخدام التحليل الكهربائي لتمرير تيار كهربائي من خلال محلول من الماء وكلوريد البوتاسيوم. ينتج عن التفاعل KClO وغاز الهيدروجين وهيدروكسيد البوتاسيوم كمنتجات ثانوية:
2 بوكل + 2 H2O → 2 كوه + Cl2 + H2
يجب تخزين KClO المركب في مكان بارد وجاف، بعيدًا عن أشعة الشمس المباشرة والحرارة.
استخدامات هيبوكلوريت البوتاسيوم
KClO له استخدامات مختلفة في مختلف الصناعات والتطبيقات. فيما يلي بعض استخداماته الشائعة:
- معالجة المياه: يستخدم كمطهر في محطات معالجة المياه لقتل البكتيريا والكائنات الضارة الأخرى.
- المبيض: يستخدم كعامل تبييض في صناعة النسيج لتبييض الأقمشة.
- مطهر: يستخدم كمطهر في صناعة المواد الغذائية لتطهير الأسطح والمعدات الملامسة للأغذية.
- صيانة حمامات السباحة: يستخدم كمطهر وقاتل للطحالب في حمامات السباحة للحفاظ على المياه نظيفة وواضحة.
- التعقيم: يستخدم للتعقيم في الأماكن الطبية والمختبرات لتطهير المعدات والأسطح.
- مزيل الروائح الكريهة: يستخدم كمزيل للروائح الكريهة في محطات معالجة مياه الصرف الصحي لتحييد الروائح الكريهة.
- صناعة اللب والورق: يستخدم في صناعة اللب والورق كمبيض للمنتجات الورقية.
- الزراعة: يستخدم في الزراعة كمبيد حشري وفطري لحماية المحاصيل من الآفات والأمراض.
- المطهر: يستخدم كمطهر في منتجات التنظيف المنزلية لقتل الجراثيم والبكتيريا.
- صناعة النفط والغاز: يستخدم في صناعة النفط والغاز لمعالجة آبار النفط وخطوط الأنابيب للسيطرة على البكتيريا ومنع التآكل.
أسئلة:
س: ما هو هيبوكلوريت البوتاسيوم؟
ج: هيبوكلوريت البوتاسيوم مركب كيميائي له الصيغة KClO، والذي يشيع استخدامه كمادة كيميائية مطهرة ومبيضة ومعالجة المياه.
س: ما هو الرقم الهيدروجيني لمحلول 0.42 M KClO؟ [كا(HClO) = 4.0 × 10–8]
ج: يمكن حساب الرقم الهيدروجيني لمحلول 0.42 M من KClO باستخدام قيمة Ka للحمض المرافق له، HClO. الرقم الهيدروجيني حوالي 12.69.
س: ما هو هيبوكلوريت الصوديوم وهيدروكسيد البوتاسيوم؟
ج: هيبوكلوريت الصوديوم مركب كيميائي له الصيغة NaClO، ويشيع استخدامه كمبيض ومطهر. هيدروكسيد البوتاسيوم مركب كيميائي له الصيغة KOH، ويشيع استخدامه في إنتاج الصابون وككاشف مختبري.
س: ما هو الرقم الهيدروجيني لمحلول مائي تركيزه 0.116 م من KClO؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول مائي تركيزه 0.116 مولار من KClO باستخدام قيمة Kb لقاعدته المترافقة، ClO-. الرقم الهيدروجيني حوالي 11.31.
س: ما هو الرقم الهيدروجيني لمحلول مائي تركيزه 0.191 م من KClO؟
ج: يمكن حساب الرقم الهيدروجيني لمحلول مائي تركيزه 0.191 مولار من KClO باستخدام قيمة Kb لقاعدته المترافقة، ClO-. الرقم الهيدروجيني حوالي 11.92.
س: هل KClO قابل للذوبان؟
ج: نعم، KClO قابل للذوبان في الماء ويشكل محلول قلوي.
س: هل يمكنني خلط هيبوكلوريت الصوديوم وهيبوكلوريت البوتاسيوم؟
ج: لا ينصح بخلط هيبوكلوريت الصوديوم مع KClO لأنه يمكن أن يسبب تفاعل كيميائي ينتج عنه حرارة وغازات وربما يكون ضارًا بالمنتجات.
