هيبوكلوريت الكالسيوم (Ca(ClO)2) هو مركب كيميائي يشيع استخدامه كمطهر ومبيض. وهو فعال في قتل البكتيريا والفيروسات والطحالب في معالجة المياه والصرف الصحي.
| اسم الأيوباك | هيبوكلوريت الكالسيوم |
| الصيغة الجزيئية | الكالسيوم (ClO)2 |
| CAS رقم | 7778-54-3 |
| المرادفات | ملح الكالسيوم من حمض هيبوكلوروس، مسحوق التبييض، الجير المكلور، أوكسي كلوريد الكالسيوم، HTH، كال هيبو |
| إنتشي | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
خصائص هيبوكلوريت الكالسيوم
صيغة هيبوكلوريت الكالسيوم
يحتوي هيبوكلوريت الكالسيوم على الصيغة الكيميائية Ca(ClO)2. وهي مادة صلبة بلورية بيضاء اللون تعطي رائحة كلور قوية. توضح صيغة هيبوكلوريت الكالسيوم أنه يحتوي على أيون Ca+2 واحد وأيونات ClO-. يحتوي أيون الهيبوكلوريت على شحنة سالبة وهو المسؤول عن خصائص الأكسدة القوية للمركب.
هيبوكلوريت الكالسيوم الكتلة المولية
الكتلة المولية لـ Ca(ClO)2 هي 142.98 جم/مول. يتم حسابه عن طريق إضافة الكتل الذرية للكالسيوم والكلور والأكسجين الموجودة في جزيء Ca(ClO)2. تعد الكتلة المولية لـ Ca(ClO)2 معلمة مهمة تستخدم في الحسابات الكيميائية المختلفة.
نقطة غليان هيبوكلوريت الكالسيوم
يتحلل Ca(ClO)2 قبل أن يصل إلى نقطة الغليان. ولذلك فإن نقطة الغليان ليست محددة بشكل جيد. عندما يتم تسخين Ca(ClO)2، فإنه يخضع للتحلل الحراري لتكوين كلوريد الكالسيوم والأكسجين وغاز الكلور.
نقطة انصهار هيبوكلوريت الكالسيوم
درجة انصهار Ca(ClO)2 هي 100 درجة مئوية. عند درجة الحرارة هذه، يذوب Ca(ClO)2 ليشكل سائلًا صافًا. Ca(ClO)2 قابل للذوبان بشدة في الماء، وعندما يذوب في الماء فإنه يطلق أيونات هيبوكلوريت، مما يجعله مطهرًا فعالاً.
كثافة هيبوكلوريت الكالسيوم جم/مل
تبلغ كثافة Ca(ClO)2 2.35 جم/مل. وهو مركب كثيف نسبيا وأثقل من الماء. ترجع الكثافة العالية لـ Ca(ClO)2 إلى وجود أيونات الكالسيوم في شبكتها البلورية.
هيبوكلوريت الكالسيوم الوزن الجزيئي
الوزن الجزيئي لـ Ca(ClO)2 هو 142.98 جم/مول. يتم حسابه عن طريق إضافة الكتل الذرية للكالسيوم والكلور والأكسجين الموجودة في جزيء Ca(ClO)2. يعد الوزن الجزيئي لـ Ca(ClO)2 عاملاً مهمًا يستخدم في الحسابات الكيميائية المختلفة.
هيكل هيبوكلوريت الكالسيوم
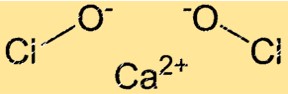
يحتوي Ca(ClO)2 على بنية بلورية. تتكون الشبكة البلورية Ca(ClO)2 من أيونات Ca+2 وأيونات ClO-. يتم ترتيب أيونات ClO- في هندسة رباعية السطوح حول أيونات Ca+2. إن البنية الشبكية البلورية لـ Ca(ClO)2 تمنحها خصائص مؤكسدة قوية.
ذوبان هيبوكلوريت الكالسيوم
Ca(ClO)2 قابل للذوبان بشدة في الماء. يذوب في الماء ليشكل أيون هيبوكلوريت وأيون كالسيوم. تزداد ذوبان Ca(ClO)2 في الماء مع زيادة درجة الحرارة. Ca(ClO)2 قابل للذوبان أيضًا في المذيبات العضوية مثل الأسيتون والإيثانول.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.35 |
| لون | أبيض |
| يشم | رائحة الكلور |
| الكتلة المولية | 142.98 جرام/مول |
| كثافة | 2.35 جم/سم3 |
| نقطة الانصهار | 100 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 21 جم/100 مل (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الأسيتون والإيثانول والجلسرين والماء |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 7.5 |
| الرقم الهيدروجيني | ~11 |
سلامة ومخاطر هيبوكلوريت الكالسيوم
يمكن أن يكون Ca(ClO)2 خطيرًا إذا لم يتم التعامل معه بشكل صحيح. وهو عامل مؤكسد قوي يمكن أن يتفاعل بعنف مع المركبات العضوية، ويطلق غازات سامة. قد يسبب تهيج الجلد والعين، كما أن التعرض له لفترة طويلة قد يؤدي إلى مشاكل في الجهاز التنفسي. يجب أن يتم تخزينه في مكان بارد وجاف وجيد التهوية، بعيدا عن المواد العضوية وعوامل الاختزال والأحماض. يجب التعامل مع Ca(ClO)2 بعناية ويجب ارتداء معدات الحماية، مثل القفازات والنظارات الواقية، عند التعامل معه. ولا ينبغي خلطه مع مواد كيميائية أخرى، بما في ذلك الأحماض أو عوامل الاختزال، لأن ذلك قد يسبب انفجارًا.
| رموز الخطر | أو، شي، ن |
| وصف الأمان | ضار إذا تم ابتلاعه، يسبب تهيج الجلد، يسبب تهيجًا خطيرًا للعين، قد يسبب السرطان |
| أرقام تعريف الأمم المتحدة | UN1748 |
| رمز النظام المنسق | 2828.90.00 |
| فئة الخطر | 5.1 (العوامل المؤكسدة) |
| مجموعة التعبئة | ثانيا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران) = 850 ملغم/كغم؛ التركيز المميت النصفي (الاستنشاق، الفئران) = 10.8 ملجم/م3 (التعرض لمدة 4 ساعات) |
طرق تصنيع هيبوكلوريت الكالسيوم
هناك عدة طرق لتجميع Ca(ClO)2.
تتضمن إحدى الطرق خلط غاز الكلور مع الجير المطفأ، المعروف أيضًا باسم هيدروكسيد الكالسيوم ، في الماء. ينتج عن التفاعل Ca(ClO)2 وكلوريد الكالسيوم والماء. تتضمن الطريقة الأخرى تفاعل غاز الكلور مع هيدروكسيد الكالسيوم الجاف، مما ينتج عنه Ca(ClO)2 وبخار الماء.
تتضمن عملية إنتاج Ca(ClO)2 واسعة النطاق عادةً تفاعل هيبوكلوريت الصوديوم مع كلوريد الكالسيوم ، مما ينتج عنه Ca(ClO)2 وكلوريد الصوديوم.
تتضمن الطريقة الأخرى تفاعل كربونات الكالسيوم مع غاز الكلور في وجود الماء أو حمض الأسيتيك. وينتج عن التفاعل Ca(ClO)2، وثاني أكسيد الكربون، والماء أو أسيتات الكالسيوم، وحمض الهيدروكلوريك.
تتطلب هذه الطرق معالجة دقيقة ومعدات مناسبة لضمان السلامة والفعالية. يعتمد اختيار الطريقة على حجم الإنتاج والنقاء المطلوب للمنتج النهائي.
استخدامات هيبوكلوريت الكالسيوم
يحتوي Ca(ClO)2 على نطاق واسع من الاستخدامات بسبب خصائصه المؤكسدة والتطهيرية القوية. فيما يلي بعض الاستخدامات الشائعة لـ Ca(ClO)2:
- معالجة المياه: تستخدم على نطاق واسع لتطهير المياه في حمامات السباحة وأنظمة مياه الشرب ومحطات معالجة مياه الصرف الصحي.
- المبيض: يستخدم كعامل تبييض للقطن والكتان ولب الورق، وكذلك في صناعة الورق والمنسوجات.
- التطهير: يستخدم عادة لتطهير الأسطح والمعدات في صناعة المواد الغذائية.
- إزالة الروائح: يستخدم لإزالة الروائح الكريهة من الأقمشة والسجاد وغيرها من المواد.
- المطهر: مطهر فعال للمستشفيات والمختبرات ومؤسسات الرعاية الصحية الأخرى.
- مكافحة الطحالب: يستخدم للتحكم في نمو الطحالب في المسطحات المائية مثل البرك والبحيرات.
- التخليق الكيميائي: يستخدم في تخليق المركبات العضوية وغير العضوية المختلفة.
- الاستخدام المنزلي: يستخدم كمطهر منزلي، وخاصة لتنظيف وتطهير المراحيض والأنابيب.
- حفر آبار النفط: يستخدم أيضاً في حفر آبار النفط لمنع نمو البكتيريا والكائنات الحية الدقيقة الأخرى.
أسئلة:
س: هل يمكنك استخدام هيبوكلوريت الكالسيوم لإزالة الوشم؟
ج: لا، لا ينبغي استخدام Ca(ClO)2 لإزالة الوشم. وهو عامل مؤكسد قوي يمكن أن يسبب تلفًا خطيرًا في الجلد وتندبًا.
س: كيف يتم تخزين هيبوكلوريت الكالسيوم؟
ج: يجب تخزين Ca(ClO)2 في مكان بارد وجاف وجيد التهوية، بعيدًا عن أشعة الشمس المباشرة ومصادر الحرارة والمواد غير المتوافقة. يجب أن يتم تخزينه في حاوية مغلقة جيدا ومحمية من الرطوبة والماء.
س: أين يمكن شراء هيبوكلوريت الكالسيوم؟
ج: يمكن شراء Ca(ClO)2 من شركات توريد المواد الكيميائية ومتاجر مستلزمات حمامات السباحة وتجار التجزئة عبر الإنترنت.
س: ما هي كمية هيبوكلوريت الكالسيوم لمياه الشرب؟
ج: تعتمد كمية Ca(ClO)2 اللازمة لمعالجة مياه الشرب على تركيز المحلول وحجم المياه المراد معالجتها. تتراوح الجرعة الموصى بها عمومًا بين 0.2 و0.5 جزء في المليون (جزء في المليون) للتطهير المنتظم.
س: ما هي كمية هيبوكلوريت الكالسيوم الآمن تناولها؟
ج: لا ينبغي أبدًا تناول Ca(ClO)2، لأنه شديد السمية ويمكن أن يسبب مشاكل صحية خطيرة أو حتى الموت.
س: تنقية المياه بهيبوكلوريت الكالسيوم؟
ج: يستخدم Ca(ClO)2 بشكل شائع لتنقية المياه وتطهيرها في مجموعة متنوعة من الأماكن، بما في ذلك حمامات السباحة، وأنظمة مياه الشرب، ومحطات معالجة مياه الصرف الصحي.
س: صدمة هيبوكلوريت الكالسيوم؟
ج: صدمة Ca(ClO)2 هي عملية إضافة تركيز أعلى من Ca(ClO)2 إلى حمام السباحة أو المنتجع الصحي لزيادة مستويات الكلور بسرعة والقضاء على البكتيريا الضارة والملوثات.
س: هيبوكلوريت الكالسيوم لتطهير المياه؟
ج: يعتبر Ca(ClO)2 مطهرًا قويًا يستخدم غالبًا لمعالجة المياه وتنقيتها للقضاء على البكتيريا والفيروسات وغيرها من الكائنات الحية الدقيقة الضارة.
س: هل Ca(OCl)2 حمض أم قاعدة؟
ج: هيبوكلوريت الكالسيوم (Ca(OCl)2) هو قاعدة لأنه يمكنه قبول بروتون لتكوين أيون هيدروكسيد.
س: ما الشكل المخفض من Ca(OCl)2 المتبقي في نهاية التجربة؟
ج: إن الشكل المخفض لـ Ca(OCl)2 الذي يبقى في نهاية التجربة يعتمد على التفاعل المحدد الذي يحدث. في بعض الحالات قد يكون كلوريد الكالسيوم (CaCl2) أو كربونات الكالسيوم (CaCO3).
