ثيوكبريتات البوتاسيوم (K2S2O3) هو مركب كيميائي يستخدم في التصوير الفوتوغرافي، كعامل اختزال وتحييد الكلور في حمامات السباحة. له مظهر بلوري أبيض وقابل للذوبان في الماء.
| اسم الأيوباك | ثيوكبريتات البوتاسيوم |
| الصيغة الجزيئية | K2S2O3 |
| CAS رقم | 10294-66-3 |
| المرادفات | هيبوكبريتيت البوتاسيوم، ثيوكبريتات البوتاسيوم، ثيوسلفات البوتاسيوم بنتاهيدرات، ثيوسلفات البوتاسيوم بنتاهيدرات، سلفوروثيويت البوتاسيوم، حمض سلفوروثيويك البوتاسيوم |
| إنتشي | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
خصائص ثيوكبريتات البوتاسيوم
صيغة ثيوكبريتات البوتاسيوم
تشير الصيغة الكيميائية لثيوكبريتات البوتاسيوم (K2S2O3) إلى عدد ونوع الذرات الموجودة في المركب. تتكون الصيغة من ذرتين بوتاسيوم وذرتين كبريت وثلاث ذرات أكسجين. تحمل ذرات البوتاسيوم شحنة موجبة، بينما تحمل ذرات الكبريت والأكسجين شحنة سالبة.
ثيوكبريتات البوتاسيوم الكتلة المولية
الكتلة المولية لـ K2S2O3 هي 190.33 جم/مول. الكتلة المولية هي كتلة مول واحد من المادة ويتم حسابها عن طريق إضافة الكتل الذرية لجميع الذرات في الصيغة الكيميائية. في حالة K2S2O3، تتكون الصيغة من ذرتين بوتاسيوم، وذرتين كبريت، وثلاث ذرات أكسجين.
درجة غليان ثيوكبريتات البوتاسيوم
K2S2O3 ليس له نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. يحدث التحلل عندما تصل درجة الحرارة إلى حوالي 100 درجة مئوية ويتم إطلاق ثاني أكسيد الكبريت. لذلك، لا يتم استخدام المركب بشكل عام في تطبيقات درجات الحرارة العالية.
نقطة انصهار ثيوكبريتات البوتاسيوم
نقطة انصهار K2S2O3 هي 48.3 درجة مئوية. تعتبر درجة الحرارة هذه منخفضة نسبياً مقارنة بالمركبات الكيميائية الأخرى. عند تسخينه إلى درجة الحرارة هذه، يصبح الصلب K2S2O3 سائلاً.
كثافة ثيوكبريتات البوتاسيوم جم/مل
تبلغ كثافة K2S2O3 1.667 جم / مل. الكثافة هي مقياس لكمية الكتلة الموجودة في حجم معين. تعني هذه القيمة أن الملليلتر الواحد من K2S2O3 له كتلة 1.667 جرام.
الوزن الجزيئي لثيوكبريتات البوتاسيوم
الوزن الجزيئي لـ K2S2O3 هو 190.33 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب. وغالبا ما يستخدم للتحويل بين الشامات والجرامات من المادة.
هيكل ثيوكبريتات البوتاسيوم
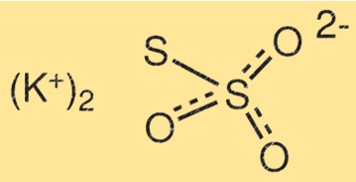
يتكون هيكل K2S2O3 من ذرتين بوتاسيوم، وذرتين كبريت، وثلاث ذرات أكسجين. ترتبط ذرات الكبريت ببعضها البعض بواسطة رابطة مزدوجة، بينما ترتبط ذرة الكبريت الأخرى بإحدى ذرات الأكسجين. ترتبط ذرات البوتاسيوم بذرات الأكسجين المتبقية.
ذوبان ثيوكبريتات البوتاسيوم
K2S2O3 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ 432 جم / لتر عند 20 درجة مئوية. وهذا يجعله مركبًا فعالاً لمعالجة المياه وكعامل تثبيت للصور الفوتوغرافية. ومع ذلك، فهو غير قابل للذوبان في المذيبات العضوية مثل الإيثانول أو الأسيتون.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1,667 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 190.33 جرام/مول |
| كثافة | 1,667 جم/مل |
| نقطة الانصهار | 48.3 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | شديد الذوبان (432 جم/لتر عند 20 درجة مئوية) |
| الذوبان | غير قابلة للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | 6.0 – 9.0 (5% محلول مائي) |
سلامة ومخاطر ثيوكبريتات البوتاسيوم
يعتبر K2S2O3 بشكل عام آمنًا للتعامل والاستخدام عند اتخاذ الاحتياطات المناسبة. ومع ذلك، من المهم أن تكون على دراية ببعض المخاطر المحتملة المرتبطة بهذا المركب. قد يؤدي التعرض لغبار أو بخار K2S2O3 إلى تهيج العينين والجلد والجهاز التنفسي. قد يؤدي تناول المركب أيضًا إلى الغثيان والقيء والإسهال. بالإضافة إلى ذلك، قد يسبب الاتصال بالمركب التهاب الجلد أو حساسية الجلد لدى بعض الأشخاص. كما هو الحال مع أي مادة كيميائية، من المهم اتباع بروتوكولات السلامة المناسبة عند التعامل مع K2S2O3 لتجنب التعرض وتقليل مخاطر الحوادث.
| رموز الخطر | الحادي عشر |
| وصف الأمان | S22 – لا تتنفس الغبار. S24/25 – تجنب ملامسة الجلد والعينين. S37/39 – ارتداء القفازات المناسبة وحماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 3077 |
| رمز النظام المنسق | 2832.10.00 |
| فئة الخطر | 9- المواد الخطرة المتنوعة |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 2500 ملغم/كغم |
طرق تخليق ثيوكبريتات البوتاسيوم
يمكن تصنيع K2S2O3 بطرق مختلفة، بما في ذلك تفاعل الكبريت مع كبريتيت البوتاسيوم في وجود هيدروكسيد فلز قلوي.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد البوتاسيوم مع غاز الكبريت وثاني أكسيد الكبريت. ينتج عن هذا التفاعل K2S2O3 وكبريتات البوتاسيوم كمنتجات ثانوية.
تتضمن طريقة التصنيع البديلة تفاعل كبريتيت البوتاسيوم مع ثيوكبريتات الصوديوم في محلول مائي. يمكن ترشيح الراسب الناتج وغسله للحصول على K2S2O3 النقي.
لتحضير K2S2O3 في المختبر، يمكن تفاعل هيدروكسيد البوتاسيوم مع الكبريت، ثم إضافة غاز ثاني أكسيد الكبريت إلى الخليط. المنتج الناتج عبارة عن مادة صلبة بلورية بيضاء يمكن تنقيتها بشكل أكبر عن طريق إعادة البلورة.
استخدامات ثيوكبريتات البوتاسيوم
K2S2O3 له العديد من الاستخدامات المهمة في مختلف الصناعات. فيما يلي بعض تطبيقاته الأكثر شيوعًا:
- التصوير الفوتوغرافي: يستخدم ثيوكبريتات البوتاسيوم كعامل تثبيت في معالجة الصور الفوتوغرافية لإزالة هاليدات الفضة غير المستخدمة ومنع بهتان الصورة.
- الزراعة: يستخدم ثيوكبريتات البوتاسيوم كسماد لتزويد النباتات بالكبريت والبوتاسيوم، وهما عنصران غذائيان مهمان للنمو والتطور.
- معالجة المياه: يستخدم ثيوكبريتات البوتاسيوم لإزالة الكلور من مياه حمامات السباحة والمنتجعات الصحية، وكذلك لتحييد آثار الكلور في معالجة مياه الصرف الصناعي.
- الكيمياء التحليلية: يستخدم ثيوكبريتات البوتاسيوم في الكيمياء التحليلية كعامل اختزال لتحديد تركيز اليود والعوامل المؤكسدة الأخرى.
- العلاجات الطبية: يُستخدم ثيوسلفات البوتاسيوم في بعض العلاجات الطبية، مثل علاج التسمم بالسيانيد.
- التطبيقات الصناعية: يستخدم ثيوكبريتات البوتاسيوم في التطبيقات الصناعية المختلفة، مثل الطلاء الكهربائي، ودباغة الجلود، واستخراج النفط.
أسئلة:
س: كيف يمكنك تحديد ما إذا كان هناك شيء ما هو عامل اختزال ثيوكبريتات البوتاسيوم؟
ج: يعتبر K2S2O3 عامل اختزال لأنه يمتلك القدرة على منح الإلكترونات إلى جزيئات أو أيونات أخرى، مما يقلل من حالة الأكسدة الخاصة بها.
س: ما الذي يجعل ثيوكبريتات البوتاسيوم عامل اختزال؟
ج: يحتوي K2S2O3 على ذرة كبريت ذات حالة أكسدة أقل من الكبريتات، مما يسمح لها بالتبرع بالإلكترونات إلى جزيئات أو أيونات أخرى والعمل كعامل اختزال.
س: هل يحرق ثيوكبريتات البوتاسيوم الخضار الخضراء؟
ج: لا، K2S2O3 لا يحرق الخضر. وهي مادة صلبة بلورية بيضاء ولا تظهر أي لون أخضر.
س: ما هي الذوبان المولي لـ AgCl في 1.0 M K2S2O3؟
ج: تعتمد قابلية الذوبان المولي لـ AgCl في 1.0 M K2S2O3 على عوامل مختلفة مثل درجة الحرارة والقوة الأيونية. لا يمكن تحديد القيمة الدقيقة دون معلومات إضافية.
س: ما هو رقم الشحنة أو التأكسد لـ K في 2 (K2S2O3)؟
ج: عدد الشحنة أو الأكسدة للـ K في 2 (K2S2O3) هو +1.
س: ما هي حالة أكسدة S في K2S2O3؟
ج: حالة أكسدة S في K2S2O3 هي +2.
س: ما عدد الجزيئات الموجودة في 4 مولات من K2S2O3؟
ج: يوجد تقريبًا 4 × 6.022 × 10^23 جزيء من K2S2O3 في 4 مولات من K2S2O3، وهو ما يعادل 2.409 × 10^24 جزيء.
س: ما هو مقدار 4 مولات من K2S2O3؟
ج: يمكن حساب كتلة 4 مولات من K2S2O3 عن طريق ضرب الكتلة المولية لـ K2S2O3 (190.31 جم/مول) في 4، وهو ما يساوي 761.24 جرامًا. وبالتالي فإن 4 مولات من K2S2O3 تساوي 761.24 جرامًا.
