نتريت الكالسيوم (Ca(NO2)2) هو مركب كيميائي يستخدم عادة كمثبط للتآكل في الخرسانة. يساعد على منع تآكل حديد التسليح.
| اسم الأيوباك | دينتريت الكالسيوم |
| الصيغة الجزيئية | كا(NO2)2 |
| CAS رقم | 13780-06-8 |
| المرادفات | ثنائي هيدرات نتريت الكالسيوم، وحمض النيتروز، وملح الكالسيوم، وحمض النيتريك، وملح الكالسيوم، وثنائي هيدرات، وما إلى ذلك. |
| إنتشي | InChI=1S/Ca.2HNO2/c;2 2-1-3/ساعة;2 (H,2,3) |
خصائص نتريت الكالسيوم
صيغة نتريت الكالسيوم
الصيغة الكيميائية لنتريت الكالسيوم هي Ca(NO2)2. تشير هذه الصيغة إلى أن المركب يحتوي على أنيونين من النتريت لكل كاتيون كالسيوم. الصيغة مهمة في تحديد تكوين المركب وفي تحديد كمية كل عنصر في المركب.
نتريت الكالسيوم الكتلة المولية
تبلغ الكتلة المولية لـ Ca(NO2)2، والمعروفة أيضًا باسم ثنائي نيتريت الكالسيوم، حوالي 132.09 جم/مول. وهو مركب أيوني يتكون من كاتيونات الكالسيوم وأنيونات النتريت. يتم حساب الكتلة المولية عن طريق إضافة الكتل الذرية للعناصر المكونة للمركب، وهي في هذه الحالة الكالسيوم والنيتروجين والأكسجين.
درجة غليان نتريت الكالسيوم
يحتوي Ca(NO2)2 على نقطة غليان عالية تبلغ حوالي 400 درجة مئوية (752 درجة فهرنهايت). ترجع نقطة الغليان العالية هذه إلى الروابط الأيونية القوية الموجودة بين أيونات Ca2+ وNO2- في المركب. عندما يتم تسخين Ca(NO2)2، فإنه يخضع للتحلل الحراري، ويطلق ثاني أكسيد النيتروجين والأكسجين.
نقطة انصهار نتريت الكالسيوم
Ca(NO2)2 لديه نقطة انصهار تبلغ حوالي 132 درجة مئوية (270 درجة فهرنهايت). نقطة الانصهار هذه منخفضة نسبيًا مقارنة بالمركبات الأيونية الأخرى، مثل كلوريد الصوديوم، الذي تبلغ نقطة انصهاره 801 درجة مئوية (1474 درجة فهرنهايت). يمكن أن تعزى نقطة الانصهار المنخفضة لـ Ca(NO2)2 إلى الروابط الأيونية الضعيفة نسبيًا الموجودة بين أيونات Ca2+ وNO2-.
كثافة نتريت الكالسيوم جم/مل
تبلغ كثافة Ca(NO2)2 حوالي 2.32 جم/مل. تشير هذه القيمة إلى أن Ca(NO2)2 مركب كثيف نسبيًا. يتم حساب الكثافة بقسمة كتلة المركب على حجمه. يمكن أن تعزى الكثافة العالية لـ Ca(NO2)2 إلى وجود كاتيونات الكالسيوم الثقيلة نسبيًا.
الوزن الجزيئي لنترات الكالسيوم
يبلغ الوزن الجزيئي لـ Ca(NO2)2 حوالي 132.09 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية للعناصر المكونة للمركب. الوزن الجزيئي مهم في تحديد كمية Ca(NO2)2 اللازمة للحصول على عدد معين من مولات المركب.
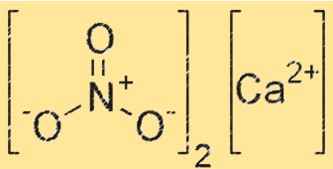
هيكل نتريت الكالسيوم
يتكون هيكل Ca(NO2)2 من Ca2+ وNO2-. توجد أيونات Ca2+ في وسط الشبكة البلورية، بينما تحيط بها أيونات NO2-. ترتبط الشبكة البلورية معًا بروابط أيونية قوية بين أيونات Ca2+ وNO2-.
ذوبان نتريت الكالسيوم
Ca(NO2)2 قابل للذوبان في الماء والكحول. قابلية الذوبان في الماء عالية نسبيًا، حيث تبلغ قابلية الذوبان حوالي 61 جم / 100 مل من الماء في درجة حرارة الغرفة. ذوبانه في الكحول أقل منه في الماء. تعد قابلية ذوبان Ca(NO2)2 مهمة في تحديد استخدامه في التطبيقات المختلفة، مثل إنتاج الخرسانة.
| مظهر | مسحوق بلوري أبيض إلى أصفر قليلاً أو صلب |
| جاذبية معينة | 2.32 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 132.09 جرام/مول |
| كثافة | 2.32 جم/مل |
| نقطة الانصهار | 132 درجة مئوية (270 درجة فهرنهايت) |
| نقطة الغليان | يتحلل عند حوالي 400 درجة مئوية (752 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والكحول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | حيادي |
سلامة ومخاطر نتريت الكالسيوم
قد يكون Ca(NO2)2 ضارًا في حالة تناوله أو استنشاقه أو ملامسته للجلد أو العينين. هذا يمكن أن يسبب تهيج وحروق ومشاكل في التنفس. يعد المركب أيضًا عاملًا مؤكسدًا ويمكن أن يتفاعل مع مواد كيميائية أخرى، مثل الأحماض والمعادن، لتكوين مواد خطرة. يجب تخزين Ca(NO2)2 في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة. ويجب ارتداء معدات الحماية الشخصية، مثل القفازات والنظارات الواقية، عند التعامل مع المجمع. وفي حالة التعرض للمرض، يجب طلب العناية الطبية الفورية وإزالة الملابس الملوثة.
| رموز الخطر | Xn |
| وصف الأمان | تجنب ملامسة الجلد والعينين؛ ارتداء معدات الحماية الشخصية (PPE)؛ إذا تعرضت، اطلب العناية الطبية على الفور. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1454 |
| رمز النظام المنسق | 2834.29.90 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثالثا |
| تسمم | ضار إذا ابتلع أو استنشق؛ يمكن أن يسبب تهيجًا وحروقًا ومشاكل في التنفس |
طرق تصنيع نتريت الكالسيوم
يمكن لطرق مختلفة تصنيع Ca(NO2)2، بما في ذلك تفاعل حمض النيتريك أو أكاسيد النيتروجين مع كربونات الكالسيوم ، وتفاعل حمض النيتروز أو أكاسيد النيتروجين مع هيدروكسيد الكربون. الكالسيوم وتفاعل هيدروكسيد الكالسيوم أو هيدروكسيد الأمونيوم مع نترات الكالسيوم.
الطريقة الشائعة هي تفاعل كربونات الكالسيوم مع حمض النيتريك لإنتاج نترات الكالسيوم. بعد ذلك، يؤدي تفاعل نترات الكالسيوم مع هيدروكسيد الكالسيوم إلى تكوين منتجات ثانوية Ca(NO2)2 وأكسيد الكالسيوم.
تتضمن الطريقة الأخرى تفاعل أكاسيد النيتروجين مع هيدروكسيد الكالسيوم لإنتاج Ca(NO2)2 ونترات الكالسيوم.
في طريقة أخرى، يمكن تفاعل نترات الكالسيوم مع هيدروكسيد الكالسيوم أو هيدروكسيد الأمونيوم لإنتاج Ca(NO2)2 أثناء توليد نترات الكالسيوم كمنتج ثانوي.
استخدامات نتريت الكالسيوم
Ca(NO2)2 له تطبيقات مختلفة في صناعات مختلفة، بما في ذلك:
- صناعة الخرسانة: يستخدم كمادة مضافة للخرسانة لزيادة متانة وقوة الهياكل الخرسانية. إنه يعمل كمثبط للتآكل، ويحمي حديد التسليح من التآكل الناجم عن الكلوريدات والأيونات العدوانية الأخرى.
- الزراعة: يستخدم كسماد في الزراعة لتوفير مصدر للنيتروجين والكالسيوم للنباتات. يستخدم أيضًا كتعديل للتربة لتحسين جودة التربة وتعزيز نمو النباتات.
- الصناعة الكيميائية: تستخدم كعامل اختزال في التفاعلات الكيميائية، كما تستخدم كمقدمة لتخليق مواد كيميائية أخرى مثل نترات الكالسيوم ونترات أمونيوم الكالسيوم.
- معالجة مياه الصرف الصحي: تستخدم كمادة كيميائية لمعالجة مياه الصرف الصحي لإزالة الملوثات وتقليل تركيز المواد الضارة في المياه.
- صناعة المواد الغذائية: تستخدم كمادة حافظة للأغذية لمنع نمو البكتيريا والكائنات الحية الدقيقة الأخرى في اللحوم والأسماك والمنتجات الغذائية الأخرى.
أسئلة:
س: ما هي صيغة نتريت الكالسيوم؟
ج: الصيغة الكيميائية لنتريت الكالسيوم هي Ca(NO2)2.
س: ما هي كمية نتريت الكالسيوم المستخدمة في الخرسانة كل عام؟
ج: تختلف كمية Ca(NO2)2 المستخدمة في الخرسانة كل عام حسب التطبيق المحدد وطلب السوق. ومع ذلك، فمن المقدر أن عدة آلاف من الأطنان من الكالسيوم (NO2)2 تستخدم في جميع أنحاء العالم كمادة مضافة للخرسانة كل عام.
س: هل نتريت الكالسيوم قابل للذوبان في الماء؟
ج: نعم، Ca(NO2)2 قابل للذوبان في الماء. تبلغ قابليته للذوبان حوالي 167 جم / لتر عند 20 درجة مئوية.
س: هل نتريت الكالسيوم ملح؟
ج: نعم، Ca(NO2)2 ملح. مركب أيوني يتكون من كاتيونات الكالسيوم (Ca2+) وأنيونات النتريت (NO2-).
س: كيف سيتم تحضير الحلول التالية؟ 1.25 لتر من محلول 0.775 م2 من Ca(NO2)2
ج: لتحضير 1.25 لتر من محلول 0.775 مولار من Ca(NO2)2، ستحتاج إلى إذابة حوالي 187.5 جم من Ca(NO2)2 في كمية كافية من الماء للحصول على حجم نهائي قدره 1.25 لتر. ويمكن حساب ذلك باستخدام صيغة الصيغة: جرام المذاب = المولارية × الحجم (باللتر) × الكتلة المولية للمذاب.
س: ما هي الصيغة المركبة الأيونية لنتريت الكالسيوم؟
ج: صيغة المركب الأيوني لـ Ca(NO2)2 هي Ca(NO2)2. ويتكون من أيون كالسيوم واحد (Ca2+) وأيوني نيتريت (NO2-).
