نترات البوتاسيوم (KNO3) عبارة عن ملح بلوري أبيض يستخدم غالبًا في الأسمدة وحفظ الأغذية والألعاب النارية. كما أنه عنصر رئيسي في بعض معاجين الأسنان للأسنان الحساسة.
| اسم الأيوباك | نترات البوتاسيوم |
| الصيغة الجزيئية | كنو3 |
| CAS رقم | 7757-79-1 |
| المرادفات | الملح الصخري؛ نترات البوتاس. نترات. الملح الصخري؛ E252؛ الملح الصخري الصيني حمض النيتريك، ملح البوتاسيوم. نيتراس كالي |
| إنتشي | إنتشي=1S/K.NO3/c;2-1(3)4/q+1;-1 |
خصائص نترات البوتاسيوم
صيغة نترات البوتاسيوم
الصيغة الكيميائية لنترات البوتاسيوم هي KNO3. توضح هذه الصيغة أن المركب يتكون من أيون بوتاسيوم واحد، وأيون نترات واحد، وثلاثة أيونات أكسجين. هذه الصيغة مفيدة لحساب كمية نترات البوتاسيوم اللازمة في التفاعل، وكذلك تحديد العناصر والأيونات الموجودة في المركب.
نترات البوتاسيوم الكتلة المولية
KNO3 له كتلة مولية تبلغ 101.1 جم/مول. الكتلة المولية هي كتلة مول واحد من المادة ويتم حسابها عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في المركب. في حالة KNO3، يتم حساب الكتلة المولية عن طريق إضافة الكتلة الذرية لذرة بوتاسيوم واحدة وذرة نيتروجين واحدة وثلاث ذرات أكسجين. هذه القيمة مفيدة لتحديد كمية KNO3 اللازمة في التفاعل ولحساب الخصائص الأخرى مثل التركيز.
درجة غليان نترات البوتاسيوم
KNO3 لديه نقطة غليان عالية نسبيًا تبلغ 1.336 درجة مئوية (2.437 درجة فهرنهايت). وهذا يعني أن الأمر يتطلب طاقة كبيرة لكسر الروابط بين ذرات المركب وتحويله من سائل إلى غاز. هذه الخاصية تجعل KNO3 مفيدًا في التطبيقات التي تتطلب تفاعلات درجات حرارة عالية، مثل صناعة الألعاب النارية.
نقطة انصهار نترات البوتاسيوم
KNO3 لديه نقطة انصهار تبلغ 334 درجة مئوية (633 درجة فهرنهايت). وهذا يعني أنه عند درجات حرارة أعلى من 334 درجة مئوية، سيتحول KNO3 من الحالة الصلبة إلى الحالة السائلة. هذه الخاصية تجعل KNO3 مفيدًا في تطبيقات مثل صناعة الزجاج، حيث يتم استخدامه كتدفق لخفض نقطة انصهار السيليكا.
كثافة نترات البوتاسيوم جم/مل
تبلغ كثافة KNO3 2.109 جم / مل في درجة حرارة الغرفة. الكثافة هي مقياس الكتلة لكل وحدة حجم المادة. تعد كثافة KNO3 مهمة في تطبيقات مثل إنتاج الأسمدة، حيث يتم استخدامه كمصدر للنيتروجين والبوتاسيوم. تعتبر الكثافة مفيدة أيضًا في تحديد كمية KNO3 اللازمة في حجم معين من المحلول.
الوزن الجزيئي لنترات البوتاسيوم
الوزن الجزيئي لـ KNO3 هو 101.1 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية لجميع الذرات الموجودة في المركب. الوزن الجزيئي مفيد لحساب الخصائص الأخرى لـ KNO3، مثل كمية KNO3 اللازمة في التفاعل أو تركيز المحلول.
هيكل نترات البوتاسيوم
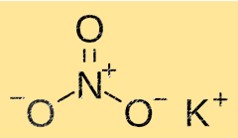
يحتوي KNO3 على بنية بلورية تتكون من أيونات البوتاسيوم والنترات والأكسجين. أيونات البوتاسيوم محاطة بستة أيونات نترات، بينما أيونات النترات محاطة بستة أيونات بوتاسيوم. يعطي هذا الهيكل KNO3 خصائصه المميزة مثل الذوبان ونقطة الانصهار والكثافة.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2.109 جم/سم3 عند 20 درجة مئوية |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 101.1032 جم/مول |
| كثافة | 2.109 جم/سم3 |
| نقطة الانصهار | 334 درجة مئوية (633 درجة فهرنهايت) |
| نقطة الغليان | 400 درجة مئوية (752 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 133 جم/لتر عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الجلسرين والأمونيا والماء |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 4.75 |
| الرقم الهيدروجيني | 6.9 – 7.3 |
سلامة ومخاطر نترات البوتاسيوم
يعد KNO3 آمنًا نسبيًا عند التعامل معه بشكل صحيح، ولكنه قد يشكل مخاطر إذا تم التعامل معه بشكل غير صحيح. ويصنف على أنه مؤكسد، مما يعني أنه يمكن أن يعزز احتراق المواد الأخرى. يمكن أن يؤدي KNO3 أيضًا إلى تهيج العينين والجلد والجهاز التنفسي، ويمكن أن يكون سامًا إذا تم تناوله أو استنشاقه بكميات كبيرة. من المهم ارتداء معدات الحماية مثل القفازات والنظارات الواقية وجهاز التنفس عند التعامل مع KNO3 وتخزينه في مكان بارد وجاف بعيدًا عن المواد القابلة للاشتعال. وينبغي أيضًا اتباع طرق التخلص المناسبة لتجنب تلوث البيئة.
| رموز الخطر | يا، اكس.ن |
| وصف الأمان | يُحفظ بعيدًا عن الحرارة/الشرر/اللهب المكشوف/الأسطح الساخنة. ارتداء القفازات الواقية / حماية العين / حماية الوجه. إذا تم ابتلاعه: اتصل بمركز السموم/الطبيب إذا شعرت بتوعك. اشطف فمك. لا تقم بتحريض القيء. في حالة الاستنشاق: أخرج الضحية إلى الهواء النقي وابقها في وضع مريح للتنفس. اتصل بمركز السموم/الطبيب. |
| أرقام تعريف الأمم المتحدة | 1486 |
| رمز النظام المنسق | 2834.21.00 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثالثا |
| تسمم | قد يسبب تهيج الجهاز التنفسي والسعال وضيق التنفس في حالة استنشاقه. قد يسبب تهيج العين والجلد. قد يسبب الابتلاع آلامًا في البطن والغثيان والقيء والإسهال. قد تكون سامة إذا تم ابتلاعها أو استنشاقها بكميات كبيرة. |
طرق تصنيع نترات البوتاسيوم
هناك عدة طرق يمكن من خلالها تصنيع KNO3.
الطريقة الشائعة هي التفاعل بين هيدروكسيد البوتاسيوم وحمض النيتريك . يقوم وعاء التفاعل بخلط المادتين وتسخينهما إلى درجة حرارة عالية، عادة حوالي 80 درجة مئوية. بعد ذلك، يبرد الخليط وتستعيد عملية الترشيح KNO3 الصلب.
طريقة أخرى هي التفاعل بين كلوريد البوتاسيوم ونترات الصوديوم. يقوم الشخص بخلط المادتين في وعاء التفاعل وتسخينهما إلى درجة حرارة عالية، عادة حوالي 600 درجة مئوية.
يذوب الخليط الناتج ثم يتصلب مكونًا بلورات KNO3.
الطريقة الثالثة تتضمن أكسدة الأمونيا بواسطة حمض النيتريك في وجود محفز. هذه الطريقة أكثر تعقيدًا وتستخدم بشكل عام على نطاق صناعي.
يمكن استخراج KNO3 من مصادر طبيعية، مثل الكهوف والرواسب الجوفية. ومع ذلك، فإن هذه الطريقة أقل شيوعًا بسبب انخفاض الإنتاج والشوائب الموجودة في KNO3 المستخرج.
استخدامات نترات البوتاسيوم
لدى KNO3 مجموعة واسعة من الاستخدامات في مختلف الصناعات بسبب خصائصه الكيميائية. فيما يلي بعض الاستخدامات الشائعة لـ KNO3:
- الأسمدة – تستخدم كسماد بسبب محتواها العالي من النيتروجين والبوتاسيوم. وهو مفيد بشكل خاص للمحاصيل التي تتطلب مستويات عالية من البوتاسيوم، مثل الفواكه والخضروات والتبغ.
- حفظ الطعام – يستخدم أيضًا كمادة حافظة للأغذية، خاصة في اللحوم المعالجة. فهو يمنع نمو البكتيريا ويمنع التلف، وبالتالي يطيل العمر الافتراضي للمنتج.
- الألعاب النارية – وهي عنصر أساسي في صناعة الألعاب النارية وأجهزة الألعاب النارية الأخرى. وهو يعمل كعامل مؤكسد، وينتج الأكسجين الذي يغذي احتراق المواد الأخرى.
- معجون الأسنان – يضاف إلى بعض معاجين الأسنان لتقليل حساسية الأسنان. وهو يعمل عن طريق منع انتقال إشارات الألم من عصب الأسنان إلى الدماغ.
- الاستخدامات الطبية – يستخدم طبيًا لخصائصه المدرة للبول والبلغم. كما يعالج الذبحة الصدرية وارتفاع ضغط الدم.
- التطبيقات الصناعية – تستخدم أيضًا في التطبيقات الصناعية المختلفة، مثل إنتاج الزجاج والسيراميك والأصباغ.
أسئلة:
س: هل نترات البوتاسيوم قابلة للذوبان في الماء؟
ج: نعم، KNO3 قابل للذوبان بدرجة عالية في الماء. في درجة حرارة الغرفة، يمكن لـ 100 جرام من الماء أن يذيب حوالي 37 جرامًا من KNO3.
س: ما هو استخدام نترات البوتاسيوم؟
ج: يستخدم KNO3 في مجموعة متنوعة من الأغراض، بما في ذلك الأسمدة، والمواد الحافظة للأغذية، وأكسدة الألعاب النارية، ومكون معجون الأسنان، وكعنصر في إنتاج الزجاج والسيراميك والأصباغ.
س: ما هي نترات البوتاسيوم؟
ج: نترات البوتاسيوم، والمعروفة أيضاً بالملح الصخري، هي مركب كيميائي له الصيغة KNO3. وهو ملح أيوني يتكون من أيونات البوتاسيوم (K+) وأيونات النترات (NO3-).
س: ما الذي يحيد نترات البوتاسيوم؟
ج: يمكن لأيونات الكالسيوم والمغنيسيوم مقاومة التأثيرات الضارة للإفراط في KNO3 في النباتات. في البشر، لا يوجد ترياق معروف للتسمم بـ KNO3 والعلاج مفيد جدًا.
س: هل kno3 قابل للذوبان في الماء؟
ج: نعم، KNO3 قابل للذوبان بدرجة عالية في الماء.
س: ما هو منتج التحليل الكهربائي للماء الذي يحتوي على تركيز منخفض من kno3؟
ج: إن نواتج التحليل الكهربائي للماء التي تحتوي على تركيز منخفض من KNO3 هي غاز الهيدروجين (H2) وغاز الأكسجين (O2).
س: ما هو kno3؟
ج: KNO3 هي الصيغة الكيميائية لنترات البوتاسيوم، المعروفة أيضًا باسم الملح الصخري.
س: ما هي حالة الأكسدة لذرة النيتروجين الفردية في kno3؟
ج: في KNO3، حالة الأكسدة لكل ذرة نيتروجين هي +5.
س: هل kno3 حمض أم قاعدة؟
ج: KNO3 ليس حمضًا ولا قاعدة. وهو ملح يتكون من كاتيون (K+) وأنيون (NO3-).
