أكسيد البوتاسيوم (K2O) مركب كيميائي يتكون من ذرتين بوتاسيوم وذرة أكسجين واحدة. يستخدم عادة في إنتاج الأسمدة بسبب محتواه العالي من البوتاسيوم.
| اسم الأيوباك | أكسيد البوتاسيوم |
| الصيغة الجزيئية | K2O |
| CAS رقم | 12136-45-7 |
| المرادفات | البوتاس، أكسيد ثنائي البوتاسيوم، أول أكسيد البوتاسيوم |
| إنتشي | إن تشي = 1S/2K.O |
خصائص أكسيد البوتاسيوم
صيغة أكسيد البوتاسيوم
صيغة أكسيد البوتاسيوم هي K2O. وهذا يعني أن كل جزيء K2O يحتوي على ذرتين K وذرة O واحدة. تعتبر صيغة أكسيد البوتاسيوم مهمة في الحسابات الكيميائية، مثل تحديد الكتلة المولية وقياس العناصر الكيميائية للمركب في التفاعلات الكيميائية.
الكتلة المولية لأكسيد البوتاسيوم
يحتوي K2O على كتلة مولية تبلغ 94.2 جم / مول. وهذا يعني أن المول الواحد من K2O يحتوي على 94.2 جرامًا من المركب. تعتبر الكتلة المولية للمركب مهمة في العديد من الحسابات الكيميائية، مثل تحديد كمية المركب اللازمة للتفاعل أو كتلة عينة من المركب.
نقطة غليان أكسيد البوتاسيوم
K2O لديه نقطة غليان عالية تبلغ 3150 درجة مئوية (5720 درجة فهرنهايت). ترجع نقطة الغليان المرتفعة هذه إلى الروابط الأيونية القوية بين ذرات البوتاسيوم والأكسجين في المركب. يعتبر K2O مادة صلبة عند درجة حرارة الغرفة والضغط، ولكن عند درجات حرارة عالية جدًا يمكن أن يتبخر إلى غاز.
نقطة انصهار أكسيد البوتاسيوم
نقطة انصهار K2O هي 740 درجة مئوية (1364 درجة فهرنهايت). وهذا يعني أنه عند درجات حرارة أعلى من 740 درجة مئوية، سوف يذوب K2O ويصبح سائلاً. نقطة انصهار K2O مرتفعة نسبيًا مقارنة بالمركبات الأيونية الأخرى، مثل كلوريد الصوديوم (801 درجة مئوية) وأكسيد المغنيسيوم (2852 درجة مئوية).
كثافة أكسيد البوتاسيوم جم/مل
كثافة K2O هي 2.32 جم/سم3. هذه الكثافة أكبر من كثافة الماء (1 جم/سم مكعب) وتشير إلى أن K2O مركب كثيف نسبيًا. ترجع الكثافة العالية لـ K2O إلى قرب ذرات البوتاسيوم والأكسجين في البنية الشبكية البلورية للمركب.
الوزن الجزيئي لأكسيد البوتاسيوم
الوزن الجزيئي لـ K2O هو 94.2 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء المركب. الوزن الجزيئي لـ K2O مهم في الحسابات المتكافئة، مثل تحديد كمية المواد المتفاعلة اللازمة للتفاعل الكيميائي.
هيكل أكسيد البوتاسيوم
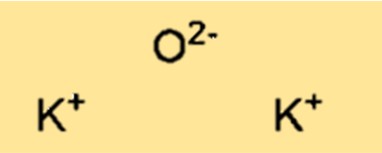
يحتوي K2O على هيكل شبكي كريستالي. يتكون الهيكل من كاتيونات البوتاسيوم (K+) وأنيونات الأكسيد (O2-) مرتبة في نمط متكرر ثلاثي الأبعاد. يعد الهيكل الشبكي البلوري لـ K2O مهمًا في تحديد الخواص الفيزيائية والكيميائية للمركب.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.32 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 94.2 جرام/مول |
| كثافة | 2.32 جم/سم3 |
| نقطة الانصهار | 740 درجة مئوية (1364 درجة فهرنهايت) |
| نقطة الغليان | 3,150 درجة مئوية (5,720 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل بعنف مع الماء |
| الذوبان | غير قابلة للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر أكسيد البوتاسيوم
يقدم K2O العديد من المخاطر والمخاطر المتعلقة بالسلامة. يتفاعل بعنف مع الماء، ويطلق كمية كبيرة من الحرارة وينتج هيدروكسيد البوتاسيوم. يمكن أن يسبب رد الفعل هذا حروقًا وحرائق، لذا من المهم التعامل مع K2O بعناية. قد يؤدي استنشاق أو ابتلاع K2O إلى تهيج الجهاز التنفسي والعينين والجلد. بالإضافة إلى ذلك، يمكن أن تؤدي درجة الحرارة العالية المطلوبة لإذابة أو تبخير K2O إلى حدوث حرق أو خطر الحريق. ولذلك، ينبغي ارتداء معدات الحماية المناسبة، بما في ذلك القفازات والنظارات الواقية وجهاز التنفس الصناعي، عند التعامل مع K2O لتقليل هذه المخاطر.
| رموز الخطر | المؤكسدة والتآكل |
| وصف الأمان | الابتعاد عن الماء، لا تستنشق، ارتداء معدات الحماية |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 2257 |
| رمز النظام المنسق | 2815.20 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | يسبب تآكل الجلد والعينين، وقد يؤدي استنشاقه إلى تهيج الجهاز التنفسي |
طرق تصنيع أكسيد البوتاسيوم
يمكن لطرق مختلفة تصنيع K2O.
إحدى الطرق الشائعة هي تسخين كربونات البوتاسيوم “K” _2CO_3 إلى درجات حرارة عالية في وجود الأكسجين. تنتج هذه العملية K2O وثاني أكسيد الكربون وبخار الماء.
تتضمن الطريقة الأخرى تفاعل البوتاسيوم المعدني مع غاز الأكسجين، مما يؤدي إلى إنتاج K2O وإطلاق كمية كبيرة من الحرارة في هذه العملية.
التفاعل بين KOH وأكسيد فلز، مثل أكسيد النحاس أو أكسيد الحديد، يمكن أن ينتج K2O. ينتج عن التفاعل هيدروكسيد المعدن المقابل وK2O.
يتفاعل معدن البوتاسيوم مع الماء لإنتاج هيدروكسيد البوتاسيوم وغاز الهيدروجين، مما يؤدي إلى تخليق K2O. يؤدي جفاف هيدروكسيد البوتاسيوم إلى تكوين K2O.
في طرق ترسيب البخار الكيميائي، يقوم المفاعل ذو درجة الحرارة المرتفعة بإدخال غاز يحتوي على البوتاسيوم والأكسجين لتصنيع K2O. يخضع الغاز لتفاعل كيميائي لإنتاج K2O، الذي يترسب على سطح الركيزة.
استخدامات أكسيد البوتاسيوم
لدى K2O العديد من الاستخدامات في الصناعات المختلفة بسبب خصائصه الكيميائية والفيزيائية. فيما يلي بعض الاستخدامات الشائعة لـ K2O:
- إنتاج الأسمدة: عنصر مهم في إنتاج الأسمدة. يساعد النباتات على النمو والحفاظ على صحتها.
- صناعة الزجاج: يستخدم في صناعة الزجاج لتقليل درجة حرارة الانصهار وتحسين القوة الميكانيكية للزجاج.
- علم المعادن: يستخدم في صناعة المعادن لإنتاج المعادن مثل التيتانيوم والألومنيوم. وهذا يساعد على إزالة الشوائب وتحسين الجودة الشاملة للمنتج النهائي.
- صناعة البترول: يستخدم في صناعة البترول كعامل محفز في إنتاج الميثانول والمواد الكيميائية الأخرى.
- البطاريات: يستخدم مصنعو البطاريات K2O كإلكتروليت في إنتاج البطاريات، وخاصة البطاريات القلوية.
- المجفف: وهو مجفف قوي. يستخدم لإزالة الرطوبة من المواد، مثل المذيبات والوقود والغازات.
- الكاشف المختبري: يستخدم أيضًا ككاشف مختبري لمختلف التفاعلات والعمليات الكيميائية.
أسئلة:
س: ما الصيغة الكيميائية لأكسيد البوتاسيوم؟
ج: الصيغة الكيميائية لأكسيد البوتاسيوم هي K2O.
س: ما هي صيغة أكسيد البوتاسيوم؟
ج: صيغة أكسيد البوتاسيوم هي K2O.
س: هل أكسيد البوتاسيوم قابل للذوبان في الماء؟
ج: نعم، K2O قابل للذوبان في الماء، على الرغم من أنه يتفاعل بقوة مع الماء لإنتاج هيدروكسيد البوتاسيوم.
س: ما عدد جرامات برمنجنات البوتاسيوم اللازمة لأكسدة 2 جم من التولوين بشكل كامل؟
ج: يعتمد عدد جرامات برمنجنات البوتاسيوم اللازمة لأكسدة 2 جرام من التولوين بشكل كامل على ظروف التفاعل وقياس العناصر الكيميائية. من الضروري وجود معادلة متوازنة وظروف التفاعل لتحديد كمية برمنجنات البوتاسيوم المطلوبة.
س: هل K2O أيوني أم تساهمي؟
ج: K2O مركب أيوني يتكون من كاتيونات K+ وأنيونات O2-.
س: ما هو K2O؟
ج: K2O هي الصيغة الكيميائية لأكسيد البوتاسيوم، وهو مركب أيوني له العديد من التطبيقات الصناعية.
س: ما هو نوع الرابطة K2O؟
ج: الرابطة بين البوتاسيوم والأكسجين في K2O هي الرابطة الأيونية.
