بيروكسيد البوتاسيوم (K2O2) هو مركب يتكون من البوتاسيوم والأكسجين. وغالبا ما يستخدم كعامل مؤكسد قوي في الصناعات والمختبرات لتسهيل التفاعلات الكيميائية المختلفة.
| اسم الأيوباك | بيروكسي أوكسيدانيد البوتاسيوم |
| الصيغة الجزيئية | K2O2 |
| CAS رقم | 17014-71-0 |
| المرادفات | فوق أكسيد البوتاسيوم؛ ثاني أكسيد ثنائي البوتاسيوم. ثاني أكسيد البوتاسيوم. أكسيد البيروتاسيوم |
| إنتشي | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
خصائص بيروكسيد البوتاسيوم
صيغة بيروكسيد البوتاسيوم
الصيغة الكيميائية لبيروكسيد البوتاسيوم هي K2O2. تمثل هذه الصيغة عدد ونوع الذرات الموجودة في الجزيء. الصيغة مهمة لتحديد المادة وفهم خصائصها الكيميائية.
بيروكسيد البوتاسيوم الكتلة المولية
الكتلة المولية لـ K2O2 هي 110.2 جم / مول. وهذا يعني أن المول الواحد من K2O2 يزن 110.2 جرامًا. تعد الكتلة المولية خاصية مهمة للمادة لأنها تسمح لك بحساب كمية المادة الموجودة في كتلة أو حجم معين.
نقطة غليان بيروكسيد البوتاسيوم
ليس لدى K2O2 نقطة غليان محددة، لأنه يتحلل قبل أن يصل إلى درجة الغليان. عند درجات الحرارة المرتفعة، يتحلل K2O2 إلى أكسيد البوتاسيوم وغاز الأكسجين. لذلك، لا يتم استخدامه بشكل عام في تطبيقات درجات الحرارة العالية.
نقطة انصهار بيروكسيد البوتاسيوم
نقطة انصهار K2O2 هي 655 درجة مئوية. نقطة الانصهار العالية هذه تجعله عامل مؤكسد مناسب في تفاعلات درجات الحرارة العالية. ومع ذلك، من المهم ملاحظة أنه قد يتحلل قبل الوصول إلى نقطة الانصهار إذا تعرض لدرجات حرارة عالية أو رطوبة.
كثافة بيروكسيد البوتاسيوم جم/مل
تبلغ كثافة K2O2 2.08 جم / مل. هذه الكثافة العالية تجعلها مادة صلبة كثيفة تغوص في الماء. تعد كثافة K2O2 مهمة أيضًا في تحديد قابلية ذوبانه في المذيبات المختلفة.
الوزن الجزيئي لبيروكسيد البوتاسيوم
الوزن الجزيئي لـ K2O2 هو 110.2 جم / مول. هذه القيمة هي مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. الوزن الجزيئي هو خاصية مهمة تستخدم لحساب الخصائص المختلفة للمادة، بما في ذلك كتلتها المولية وكثافتها.
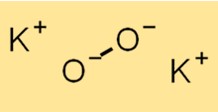
هيكل بيروكسيد البوتاسيوم
يتكون هيكل K2O2 من كاتيون K+ وأنيون O2^2-. يتكون الأنيون O2^2- من ذرتي أكسجين مرتبطتين معًا تساهميًا. يعد هيكل K2O2 ضروريًا لفهم خواصه الكيميائية وتفاعله.
| مظهر | الأبيض إلى الأصفر الشاحب الصلبة |
| جاذبية معينة | 2.08 |
| لون | الأبيض إلى الأصفر الشاحب |
| يشم | عديم الرائحة |
| الكتلة المولية | 110.2 جرام/مول |
| كثافة | 2.08 جم/مل |
| نقطة الانصهار | 655 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل مع الماء |
| الذوبان | غير قابلة للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر بيروكسيد البوتاسيوم
يشكل K2O2 العديد من مخاطر السلامة بسبب خصائصه المؤكسدة القوية. يمكن أن يتفاعل بقوة مع الماء أو الرطوبة، ويطلق غاز الأكسجين ويولد الحرارة. من المحتمل أن يتسبب رد الفعل هذا في نشوب حريق أو انفجار إذا لم يتم التعامل معه بشكل صحيح. بالإضافة إلى ذلك، يمكن أن يسبب تهيج الجلد والعين عند ملامسته، كما أن استنشاق غباره يمكن أن يسبب مشاكل في الجهاز التنفسي. من المهم التعامل مع K2O2 بعناية، وارتداء معدات الحماية الشخصية المناسبة وتخزينه في مكان بارد وجاف، بعيدًا عن مصادر الحرارة والمواد غير المتوافقة. في حالة التعرض العرضي، اطلب العناية الطبية على الفور.
| رموز الخطر | عامل مؤكسد |
| وصف الأمان | لا تعرض للماء. ارتداء القفازات الواقية وحماية العين/الوجه. يحفظ في مكان بارد وجاف، بعيداً عن مصادر الحرارة والمواد غير المتوافقة. |
| أرقام تعريف الأمم المتحدة | UN1504 |
| رمز النظام المنسق | 2829.90.90 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب تهيج الجلد والعين. استنشاق الغبار يمكن أن يسبب مشاكل في الجهاز التنفسي. |
طرق تصنيع بيروكسيد البوتاسيوم
هناك عدة طرق لتصنيع K2O2، بما في ذلك تفاعل هيدروكسيد البوتاسيوم مع بيروكسيد الهيدروجين ، وتفاعل هيدروكسيد البوتاسيوم مع بيروكسيد الباريوم، والتحلل الحراري لأكسيد البوتاسيوم الفائق.
تتضمن الطريقة الأولى إضافة هيدروكسيد البوتاسيوم ببطء إلى محلول بيروكسيد الهيدروجين مع التحريك حتى يشكل راسبًا أبيض من K2O2. تتضمن العملية تصفية الخليط وغسل المادة الصلبة بالماء البارد لإزالة الشوائب.
في الطريقة الثانية، حرك معلق بيروكسيد الباريوم مع إضافة محلول هيدروكسيد البوتاسيوم . قم بتصفية الخليط وتبخر المرشح حتى يجف. ثم قم بتسخين المادة الصلبة الناتجة إلى درجة حرارة عالية لتحلل أي بيروكسيد الباريوم المتبقي وتكوين K2O2.
تتضمن الطريقة الثالثة تسخين فوق أكسيد البوتاسيوم إلى درجة حرارة عالية، مما يؤدي إلى تحلله إلى غاز K2O2 وغاز الأكسجين.
استخدامات بيروكسيد البوتاسيوم
K2O2 له العديد من الاستخدامات في مختلف الصناعات بسبب خصائصه المؤكسدة. بعض استخداماته تشمل:
- المبيض: يستخدم كمبيض للمنسوجات والمنتجات الورقية، وكذلك منتجات تبييض الشعر والأسنان.
- مصدر الأكسجين: يستخدم كمصدر للأكسجين في الأنظمة المغلقة، كما هو الحال في الغواصات، حيث يمكن إطلاق الأكسجين عند خلطه بالماء.
- البلمرة: تستخدم في بلمرة بعض المونومرات لإنتاج البوليمرات، كما هو الحال في تصنيع البوليسترين.
- معالجة التربة: تستخدم لمعالجة التربة لإزالة الملوثات العضوية، مثل الانسكابات النفطية.
- الكيمياء التحليلية: تستخدم في الكيمياء التحليلية كعامل مؤكسد لتحديد وجود مركبات معينة.
- وقود الصواريخ: يستخدم كمادة مؤكسدة في وقود الصواريخ لقدرته على إطلاق الأكسجين.
- التركيب الكيميائي: يستخدم في تركيب المركبات العضوية وغير العضوية المختلفة، مثل تركيب برمنجنات البوتاسيوم.
أسئلة:
س: أيهما أفضل بيروكسيد الهيدروجين أم هيدروكسيد البوتاسيوم؟
ج: يعتمد ذلك على الاستخدام المقصود. بيروكسيد الهيدروجين هو عامل مؤكسد قوي ويستخدم عادة كمطهر ومبيض ومبيض للشعر والأسنان. ومن ناحية أخرى، يعتبر هيدروكسيد البوتاسيوم قاعدة قوية ويستخدم عادة في إنتاج الصابون والمنظفات، وكذلك في إنتاج وقود الديزل الحيوي من الزيوت النباتية.
س: ما هي الصيغ الكيميائية لأكسيد البوتاسيوم وبيروكسيد البوتاسيوم وأكسيد البوتاسيوم؟
ج: الصيغ الكيميائية هي K2O2 لفوق أكسيد البوتاسيوم، وK2O2 لبيروكسيد البوتاسيوم، وK2O لأكسيد البوتاسيوم.
س: ما الذي يتكون عند تفاعل بيروكسيد الهيدروجين مع يوديد البوتاسيوم واليودات؟
ج: عندما يتفاعل بيروكسيد الهيدروجين مع يوديد البوتاسيوم واليودات، يتم إنتاج اليود وفقا للتفاعل التالي: H2O2 + KI + KIO3 → I2 + K2O + H2O.
س: ما هو عدد تأكسد ذرة الأكسجين في K2O2؟
ج: عدد تأكسد ذرة الأكسجين في K2O2 هو -1.
س: ما هو عدد تأكسد K في K2O2؟
ج: عدد تأكسد K في K2O2 هو +1.
