كبريتات البوتاسيوم (K2SO4) مركب يحتوي على البوتاسيوم والكبريت والأكسجين. ويستخدم عادة كسماد لتوفير العناصر الغذائية الأساسية للنباتات وتحسين نوعية التربة.
| اسم الأيوباك | كبريتات البوتاسيوم |
| الصيغة الجزيئية | K2SO4 |
| CAS رقم | 7778-80-5 |
| المرادفات | حمض الكبريتيك، ملح ثنائي البوتاسيوم؛ كبريتات ثنائي البوتاسيوم. أركانيت. حامض الكبريتيك، ملح البوتاسيوم (1:2)؛ كبريتات البوتاسيوم. سال بوليكريستوم. نسخة غامضة مكررة |
| إنتشي | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
خصائص كبريتات البوتاسيوم
صيغة كبريتات البوتاسيوم
الصيغة الكيميائية لكبريتات البوتاسيوم هي K2SO4. وهذا يعني أن كل جزيء من كبريتات البوتاسيوم يحتوي على ذرتين بوتاسيوم، وذرة كبريت واحدة، وأربع ذرات أكسجين. تعتبر صيغة كبريتات البوتاسيوم مفيدة لتحديد قياس العناصر الكيميائية للتفاعلات التي تنطوي على المركب، وكذلك لحساب كمية كبريتات البوتاسيوم اللازمة لتطبيق معين.
كبريتات البوتاسيوم الكتلة المولية
K2SO4 لديه كتلة مولية تبلغ حوالي 174.259 جم / مول. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية لكل عنصر في المركب، وهي ذرتان بوتاسيوم، وذرة كبريت واحدة، وأربع ذرات أكسجين. تعتبر الكتلة المولية قيمة مفيدة لتحديد كمية K2SO4 اللازمة لتطبيق معين، مثل إنتاج الأسمدة أو التجارب المعملية.
نقطة غليان كبريتات البوتاسيوم
تبلغ نقطة غليان K2SO4 حوالي 1690 درجة مئوية (3074 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها المركب من سائل إلى غاز. نقطة الغليان العالية لـ K2SO4 تجعله مفيدًا للتطبيقات التي تتطلب استقرارًا في درجات الحرارة العالية، كما هو الحال في إنتاج الأسمدة والمواد الكيميائية الصناعية.
نقطة انصهار كبريتات البوتاسيوم
تبلغ نقطة انصهار K2SO4 حوالي 1.069 درجة مئوية (1.956 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة. نقطة الانصهار المرتفعة نسبيًا لـ K2SO4 تجعله مفيدًا لتطبيقات درجات الحرارة المرتفعة، مثل إنتاج الزجاج والسيراميك والأسمدة.
كثافة كبريتات البوتاسيوم جم/مل
تبلغ كثافة K2SO4 حوالي 2.66 جم / مل في درجة حرارة الغرفة. وهذا يعني أن الملليلتر الواحد من K2SO4 يزن 2.66 جرام. تعتمد كثافة K2SO4 على درجة الحرارة والضغط ويمكن استخدامها لحساب كتلة أو حجم المركب اللازم لتطبيق معين.
الوزن الجزيئي لكبريتات البوتاسيوم
الوزن الجزيئي لـ K2SO4 هو 174,259 جم / مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية لجميع العناصر الموجودة في المركب. الوزن الجزيئي مفيد لحساب كمية K2SO4 اللازمة لتطبيقات محددة، مثل الأسمدة أو المواد الكيميائية الصناعية.
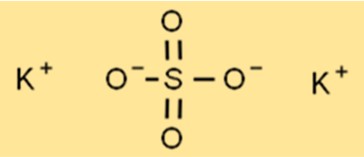
هيكل كبريتات البوتاسيوم
هيكل K2SO4 عبارة عن بنية شبكية بلورية، مع كل أيون بوتاسيوم محاط بستة أيونات أكسجين على شكل ثماني السطوح. وتقع ذرة الكبريت في وسط الشبكة، وكل ذرة كبريت محاطة بأربعة أيونات أكسجين على شكل رباعي السطوح. يمنح هذا الهيكل الشبكي K2SO4 خصائصه المميزة، مثل درجات الانصهار والغليان العالية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.66 عند 20 درجة مئوية |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 174,259 جرام/مول |
| كثافة | 2.66 جم/سم3 عند 20 درجة مئوية |
| نقطة الانصهار | 1069 درجة مئوية (1956 درجة فهرنهايت) |
| نقطة الغليان | 1,690 درجة مئوية (3,074 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 111 جم/لتر عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الماء، غير قابل للذوبان في الإيثانول |
| ضغط البخار | 0.0 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | غير قابل للتطبيق |
| pKa | الأول: 2.17؛ الثاني: 7:20 صباحاً؛ الثالث: 11.8 |
| الرقم الهيدروجيني | 5.5-8.5 (محلول 1%) |
سلامة ومخاطر سلفات البوتاسيوم
يعتبر K2SO4 بشكل عام آمنًا للاستخدام في البيئات الصناعية والزراعية والمختبرية. ومع ذلك، قد يسبب المركب تهيجًا أو ضررًا للجلد والعينين والجهاز التنفسي إذا تم تناوله أو استنشاقه بكميات كبيرة. بالإضافة إلى ذلك، يمكن أن يتفاعل K2SO4 مع مواد كيميائية معينة، مثل الأحماض القوية، لإنتاج أبخرة أو حرائق خطيرة. من المهم التعامل مع K2SO4 بعناية، باستخدام معدات الحماية المناسبة واتباع تعليمات السلامة. يجب أن يتم تخزين K2SO4 في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | لا أحد |
| وصف الأمان | S24/25: تجنب ملامسة الجلد والعينين. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 6066 |
| رمز النظام المنسق | 3104.30.00 |
| فئة الخطر | ليست خطيرة للنقل |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة |
طرق تصنيع كبريتات البوتاسيوم
توجد عدة طرق لتجميع K2SO4.
تتضمن الطريقة الشائعة تفاعل كلوريد البوتاسيوم مع حمض الكبريتيك . ينتج عن التفاعل K2SO4 وكلوريد الهيدروجين كمنتج ثانوي.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد البوتاسيوم مع حمض الكبريتيك . ينتج عن هذا التفاعل أيضًا K2SO4 والماء كمنتج ثانوي.
يمكن أيضًا الحصول على K2SO4 من معدن اللانجبينيت، وهو معدن طبيعي يحتوي على K2SO4 وكبريتات المغنيسيوم وكلوريد الصوديوم. عادة، يقوم عمال المناجم باستخراج المعدن ومعالجته لإزالة الشوائب وفصل K2SO4.
هناك طريقة أخرى لإنتاج K2SO4 تتضمن تفاعل كربونات البوتاسيوم مع حمض الكبريتيك . ينتج عن هذا التفاعل K2SO4 وثاني أكسيد الكربون كمنتج ثانوي.
استخدامات كبريتات البوتاسيوم
يحتوي K2SO4 على مجموعة واسعة من التطبيقات في مختلف الصناعات. فيما يلي بعض الاستخدامات الأكثر شيوعًا لـ K2SO4:
- الأسمدة: سماد شعبي بسبب محتواه العالي من البوتاسيوم. يستخدم في زراعة الفواكه والخضروات والمحاصيل الأخرى.
- صناعة الزجاج: تستخدم كتدفق في إنتاج الزجاج. وهذا يساعد على خفض درجة انصهار الزجاج وتحسين متانته.
- صناعة الأدوية: يستخدم كمكون في أدوية مختلفة، بما في ذلك الملينات ومحاليل استبدال الإلكتروليت.
- صناعة المواد الغذائية: يستخدم كمضاف غذائي لتنظيم الحموضة وكعامل ترك في المخبوزات.
- التطبيقات الصناعية: يستخدم في العديد من التطبيقات الصناعية، بما في ذلك إنتاج الألومنيوم وكربونات البوتاسيوم والمواد الكيميائية الأخرى.
- علف الحيوان: يستخدم كمكمل غذائي للماشية والدواجن لتعزيز النمو والتطور الصحي.
- معالجة المياه: تستخدم في معالجة المياه للتحكم في الحجم والتآكل في الغلايات والمعدات الأخرى.
أسئلة:
س: هل كبريتات البوتاسيوم قابلة للذوبان؟
ج: نعم، K2SO4 قابل للذوبان في الماء. تبلغ قابليته للذوبان حوالي 111 جم / لتر في درجة حرارة الغرفة.
س: ما هو المنتج الصلب عندما يتفاعل بروميد السترونتيوم مع كبريتات البوتاسيوم؟
ج: عندما يتفاعل بروميد السترونتيوم مع K2SO4، يكون المنتج الصلب الناتج هو كبريتات السترونتيوم (SrSO4) وهي مادة صلبة بيضاء غير قابلة للذوبان.
س: ما الأشياء الأخرى التي تنتج من تفاعل استبدال نترات الفضة وكبريتات البوتاسيوم؟
ج: في تفاعل استبدال نترات الفضة وK2SO4، يتم أيضًا إنتاج كبريتات الفضة (Ag2SO4) ونترات البوتاسيوم (KNO3).
س: هل كبريتات البوتاسيوم حمض أم قاعدة؟
ج: K2SO4 ليس حمضاً ولا قاعدة، بل هو ملح. ويتكون من تفاعل التعادل بين حمض (حمض الكبريتيك) وقاعدة (هيدروكسيد البوتاسيوم).
س: هل k2so4 قابل للذوبان في الماء؟
ج: نعم، K2SO4 قابل للذوبان في الماء. وهو شديد الذوبان وتزداد ذوبانه مع درجة الحرارة.
س: ما الملح الذي ينتج عندما يتفاعل h2so4 مع Naoh؟ k2so3 na2so4 na2so3 k2so4 A: عندما يتفاعل H2SO4 مع NaOH، فإن الملح الناتج هو Na2SO4 (كبريتات الصوديوم) مع الماء.
س: كم عدد مولات k2so4 الموجودة في 15.0 جم من k2so4؟
ج: لتحديد عدد مولات K2SO4 في 15.0 جم من K2SO4، نحتاج إلى قسمة الكتلة المعطاة على الكتلة المولية لـ K2SO4 والتي تبلغ 174.259 جم/مول. وبالتالي فإن عدد مولات K2SO4 في 15.0 جم هو 0.086 مول.
س: ما هي صيغة الراسب الذي يتكون عند خلط pb(no3)2 (aq) وk2so4 (aq)؟
ج: عندما يتم خلط Pb(NO3)2 (aq) وK2SO4 (aq)، فإن الراسب المتكون هو PbSO4 (كبريتات الرصاص)، وهي مادة صلبة بيضاء غير قابلة للذوبان. المعادلة المتوازنة لهذا التفاعل هي Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
