بيكربونات الكالسيوم (Ca(HCO3)2) مركب يحتوي على الكالسيوم والكربون والأكسجين. يوجد عادة في المياه المعدنية وهو مهم لصحة العظام ووظيفة العضلات.
| اسم الأيوباك | كربونات هيدروجين الكالسيوم |
| الصيغة الجزيئية | الكالسيوم (HCO3)2 |
| CAS رقم | 3983-19-5 |
| المرادفات | كربونات هيدروجين الكالسيوم، كربونات هيدروجين الكالسيوم، بيكربونات الكالسيوم المائية، كربونات هيدروجين الكالسيوم المائية، EINECS 223-070-3 |
| إنتشي | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
خصائص بيكربونات الكالسيوم
صيغة بيكربونات الكالسيوم
الصيغة الكيميائية لبيكربونات الكالسيوم هي Ca(HCO3)2. وهذا يدل على أن المركب يتكون من أيون Ca2+ واحد وأيونات HCO3-. الصيغة مهمة لفهم تكوين المركب وخصائصه الكيميائية. يمكن تكوين Ca(HCO3)2 عن طريق إذابة كربونات الكالسيوم في الماء المكربن أو عن طريق تفاعل هيدروكسيد الكالسيوم مع ثاني أكسيد الكربون.
الكتلة المولية لبيكربونات الكالسيوم
الكتلة المولية لـ Ca(HCO3)2 هي 162.114 جم/مول. ويتم حساب ذلك عن طريق جمع الكتل الذرية لكل عنصر في المركب. يحتوي Ca(HCO3)2 على ذرات الكالسيوم والهيدروجين والكربون والأكسجين، وتعكس الكتلة المولية الكتلة المجمعة لكل هذه الذرات. معرفة الكتلة المولية أمر مهم لتحديد كمية Ca(HCO3)2 اللازمة للتفاعلات الكيميائية أو لتحديد تركيز المحلول.
درجة غليان بيكربونات الكالسيوم
يتحلل Ca(HCO3)2 قبل أن يصل إلى نقطة الغليان. عند الضغط الجوي الطبيعي، يتحلل Ca(HCO3)2 إلى كربونات الكالسيوم والماء وثاني أكسيد الكربون عند درجات حرارة أعلى من 50 درجة مئوية. ولذلك ليس لديه نقطة الغليان.
نقطة انصهار بيكربونات الكالسيوم
ليس لدى Ca(HCO3)2 نقطة انصهار مميزة لأنه يتحلل قبل أن يصل إلى نقطة انصهاره. يتحلل إلى كربونات الكالسيوم والماء وثاني أكسيد الكربون عند درجات حرارة أعلى من 50 درجة مئوية. ومع ذلك، يمكن استخدام التحلل الحراري لـ Ca(HCO3)2 لإنتاج أكسيد الكالسيوم، الذي لديه نقطة انصهار عالية تبلغ 2613 درجة مئوية.
كثافة بيكربونات الكالسيوم جم/مل
تبلغ كثافة Ca(HCO3)2 2.21 جم/مل. وهذا يعني أن السنتيمتر المكعب الواحد من Ca(HCO3)2 يزن 2.21 جرام. كثافة Ca(HCO3)2 أقل من كثافة كربونات الكالسيوم التي تبلغ 2.71 جم/مل. كثافة المادة مهمة في تحديد كتلة المادة لكل وحدة حجم ويمكن استخدامها لحساب تركيز المحلول.
الوزن الجزيئي لبيكربونات الكالسيوم
الوزن الجزيئي لـ Ca(HCO3)2 هو 162.114 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية للكالسيوم والهيدروجين والكربون والأكسجين في المركب. الوزن الجزيئي مهم في تحديد كمية Ca(HCO3)2 اللازمة للتفاعلات الكيميائية وفي تحديد تركيز المحلول.
هيكل بيكربونات الكالسيوم
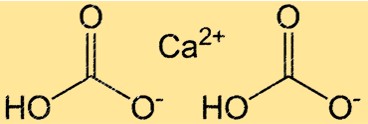
يحتوي Ca(HCO3)2 على بنية معقدة بسبب وجود الروابط الأيونية والتساهمية. يتكون المركب من أيون Ca2+ واحد وأيونات HCO3- مرتبطة ببعضها بواسطة روابط أيونية. إن HCO3- أيون نفسه عبارة عن أيون متعدد الذرات يتكون من ذرة كربون واحدة وذرتي أكسجين وذرة هيدروجين واحدة. ترتبط ذرة الكربون بذرة أكسجين مضاعفة ورابطة مفردة بالأخرى، وترتبط ذرة الهيدروجين بإحدى ذرات الأكسجين. يعد هيكل Ca(HCO3)2 مهمًا لفهم تفاعله وقابليته للذوبان في الماء.
| مظهر | بودرة بيضاء |
| جاذبية معينة | 2.21 جم/سم3 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 162,114 جم/مول |
| كثافة | 2.21 جرام/مل |
| نقطة الانصهار | يتحلل عند درجة حرارة أعلى من 50 درجة مئوية |
| نقطة الغليان | يتحلل عند درجة حرارة أعلى من 50 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء، غير قابل للذوبان في الكحول |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 6.4 – 10.3 |
| الرقم الهيدروجيني | 8.2 – 8.4 |
سلامة ومخاطر بيكربونات الكالسيوم
يعتبر Ca(HCO3)2 آمنًا بشكل عام للاستخدام في الأطعمة والمشروبات من قبل الهيئات التنظيمية. ومع ذلك، فإن استنشاق غبار Ca(HCO3)2 قد يسبب تهيج الجهاز التنفسي. ملامسة العينين قد يسبب تهيج القرنية أو تلفها. تناول كميات كبيرة من الكالسيوم (HCO3)2 قد يسبب تهيج الجهاز الهضمي. قد يؤدي التعامل مع Ca(HCO3)2 أيضًا إلى تهيج الجلد أو التهاب الجلد لدى الأفراد الحساسين. من المهم اتباع إجراءات التعامل السليم عند العمل مع Ca(HCO3)2، مثل ارتداء القفازات والنظارات الواقية. بالإضافة إلى ذلك، من المهم تخزين Ca(HCO3)2 في مكان بارد وجاف وبعيدًا عن المواد غير المتوافقة.
| رموز الخطر | لا أحد |
| وصف الأمان | غير سامة وآمنة |
| أرقام تعريف الأمم المتحدة | لا يوجد |
| رمز النظام المنسق | 2836.50.00 |
| فئة الخطر | ليست خطيرة |
| مجموعة التعبئة | لا يوجد |
| تسمم | غير سامة وآمنة |
طرق تصنيع بيكربونات الكالسيوم
تفاعل كربونات الكالسيوم (CaCO3) مع ثاني أكسيد الكربون (CO2) والماء (H2O) ينتج Ca(HCO3)2. يمكن أن يحدث هذا التفاعل بشكل طبيعي في بعض المسطحات المائية، حيث يوجد ثاني أكسيد الكربون وكربونات الكالسيوم .
لإنتاج Ca(HCO3)2، يمكن تمرير ثاني أكسيد الكربون من خلال محلول هيدروكسيد الكالسيوم (Ca(OH)2) . يشكل هذا التفاعل كربونات الكالسيوم ، والتي تتفاعل بعد ذلك مع ثاني أكسيد الكربون الزائد لتكوين Ca(HCO3)2.
هناك طريقة أخرى لتصنيع Ca(HCO3)2 تتضمن تفاعل كلوريد الكالسيوم (CaCl2) مع بيكربونات الصوديوم (NaHCO3). ينتج عن هذا التفاعل Ca(HCO3)2 بالإضافة إلى كلوريد الصوديوم (NaCl) وثاني أكسيد الكربون.
من المهم ملاحظة أن Ca(HCO3)2 مركب غير مستقر نسبيًا ويتحلل إلى كربونات الكالسيوم وثاني أكسيد الكربون في وجود الحرارة أو الظروف الحمضية. لتجنب التحلل، يجب التعامل مع Ca(HCO3)2 وتخزينه بعناية.
استخدامات بيكربونات الكالسيوم
فيما يلي بعض الاستخدامات الشائعة لـ Ca(HCO3)2:
- الأغذية والمشروبات: تستخدم كمادة مضافة للأغذية في إنتاج بعض المخبوزات والعوامل المتبقية والمشروبات الغازية.
- معالجة المياه: تستخدم لزيادة قلوية المياه مما يساعد على منع تآكل الأنابيب وتقليل حموضة مصادر المياه الحمضية.
- الزراعة: يستخدم كمعدل للتربة لزيادة محتوى الكالسيوم في التربة، مما يمكن أن يحسن بنية التربة ونمو النباتات.
- المستحضرات الصيدلانية: يستخدم في بعض تركيبات مضادات الحموضة كعامل معادل للمساعدة في تخفيف حرقة المعدة وعسر الهضم.
- البناء: يستخدم كمصدر للكالسيوم في إنتاج بعض مواد البناء، مثل الأسمنت والجص.
- التنظيف: يستخدم كمادة كاشطة خفيفة في بعض منتجات التنظيف، مثل معجون الأسنان ومساحيق التنظيف.
- مستحضرات التجميل: تستخدم كعامل منظم في بعض تركيبات مستحضرات التجميل للمساعدة في الحفاظ على درجة حموضة المنتج.
أسئلة:
س: ما هو بيكربونات الكالسيوم؟
ج: Ca(HCO3)2 عبارة عن مسحوق بلوري أبيض يتكون عندما تتفاعل كربونات الكالسيوم مع ثاني أكسيد الكربون والماء.
س: ما هي المواد الثلاثة التي يجب أن تتفاعل لتكوين بيكربونات الكالسيوم؟
ج: يجب أن تتفاعل كربونات الكالسيوم وثاني أكسيد الكربون والماء لتكوين Ca(HCO3)2.
س: هل بيكربونات الكالسيوم عامل مخفف؟
ج: نعم، يمكن استخدام Ca(HCO3)2 كعامل ترك في الخبز للمساعدة في ارتفاع العجين.
س: هل تذوب بلورات بيكربونات الكالسيوم في الأذن؟
ج: نعم، يمكن لبلورات Ca(HCO3)2 الأذنية أن تذوب من تلقاء نفسها أو مع العلاج، على سبيل المثال من خلال استخدام بعض الأدوية أو المناورات.
س: ما هو إجمالي عدد مولات الذرات الموجودة في مول واحد من Ca(HCO3)2؟
ج: يوجد 10 مولات من الذرات في مول واحد من Ca(HCO3)2.
س: كم عدد الذرات الموجودة في Ca(HCO3)2؟
ج: يوجد إجمالي 18 ذرة موجودة في Ca(HCO3)2، بما في ذلك ذرة كالسيوم واحدة وذرتان كربون و6 ذرات هيدروجين و9 ذرات أكسجين.
س: ما هو Ca(HCO3)2؟
ج: Ca(HCO3)2 هي الصيغة الكيميائية لبيكربونات الكالسيوم، وهو مركب يتكون عندما تتفاعل كربونات الكالسيوم مع ثاني أكسيد الكربون والماء.
