هيدروكسيد المغنيسيوم (Mg(OH)2) هو مضاد للحموضة وملين يستخدم لعلاج حرقة المعدة، وعسر الهضم، والإمساك. وهو يعمل عن طريق تحييد حمض المعدة وسحب الماء إلى القولون لتعزيز حركات الأمعاء.
| اسم الأيوباك | هيدروكسيد المغنيسيوم |
| الصيغة الجزيئية | ملغم(OH)2 |
| CAS رقم | 1309-42-8 |
| المرادفات | حليب المغنيسيا. بروسيت. ثنائي هيدروكسيد المغنيسيوم. هيدروماجنيسيت. المغنيسيا البيضاء |
| إنتشي | InChI=1S/2H2O.Mg/h2*1H2;/q;;+2/p-2 |
خصائص هيدروكسيد المغنيسيوم
صيغة هيدروكسيد المغنيسيوم
الصيغة الكيميائية لهيدروكسيد المغنيسيوم هي Mg(OH)2. تشير هذه الصيغة إلى أن ذرة المغنيسيوم مرتبطة بأيوني هيدروكسيد. تُستخدم صيغة هيدروكسيد المغنيسيوم لحساب الكتلة المولية والكثافة والخواص الفيزيائية الأخرى للمادة. توفر الصيغة أيضًا نظرة ثاقبة على بنية المادة، حيث تشير إلى عدد وأنواع الذرات الموجودة في جزيء هيدروكسيد المغنيسيوم.
هيدروكسيد المغنيسيوم الكتلة المولية
الكتلة المولية لـ Mg(OH)2 هي 58.32 جم/مول. هذه هي كتلة مول واحد من Mg(OH)2، الذي يحتوي على مول واحد من ذرات Mg ومولين من أيونات OH. الكتلة المولية هي مفهوم مهم في الكيمياء لأنها تستخدم لحساب كمية المادة في عينة معينة.
نقطة غليان هيدروكسيد المغنيسيوم
ليس لدى Mg(OH)2 نقطة غليان مميزة لأنه يتحلل قبل الوصول إلى نقطة الغليان. تبلغ درجة حرارة تحلل Mg(OH)2 حوالي 350 درجة مئوية. عند تسخينه، يتحلل Mg(OH)2 ليشكل أكسيد المغنسيوم والماء.
نقطة انصهار هيدروكسيد المغنيسيوم
نقطة انصهار Mg(OH)2 هي 350 درجة مئوية. عند درجة الحرارة هذه، يتغير Mg(OH)2 الصلب إلى الحالة السائلة. تُعرف هذه العملية بالدمج. تعد نقطة الانصهار خاصية فيزيائية مهمة للمادة لأنها تحدد درجة الحرارة التي تتحول عندها المادة الصلبة إلى سائل.
كثافة هيدروكسيد المغنيسيوم جم/مل
تبلغ كثافة Mg(OH)2 حوالي 2.36 جم/مل. يتم تعريف الكثافة على أنها كتلة المادة لكل وحدة حجم. Mg(OH)2 مادة كثيفة نسبيًا بسبب كتلتها المولية العالية ووجود أيونين OH لكل ذرة Mg.
الوزن الجزيئي لهيدروكسيد المغنيسيوم
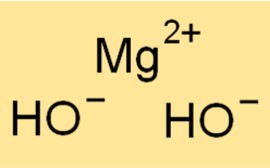
الوزن الجزيئي لـ Mg(OH)2 هو 58.32 جم/مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء Mg(OH)2. الوزن الجزيئي هو مفهوم مفيد في الكيمياء لأنه يستخدم لتحديد كمية المادة في عينة معينة.
هيكل هيدروكسيد المغنيسيوم
يحتوي Mg(OH)2 على هيكل متعدد الطبقات يتكون من أيونات Mg2+ وأيونات OH-. أيونات Mg2+ محاطة بستة أيونات OH-، ويتم ترتيب أيونات OH- في بنية سداسية متماسكة. يؤدي الهيكل الطبقي لـ Mg(OH)2 إلى ظهور خصائصه المميزة، مثل ذوبانه المنخفض في الماء وقدرته على تكوين معلق في الماء.
| مظهر | مسحوق أبيض أو معلق |
| جاذبية معينة | 2.36 جرام/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 58.32 جرام/مول |
| كثافة | 2.36 جرام/مل |
| نقطة الانصهار | 350 درجة مئوية |
| نقطة الغليان | يتحلل عند 350 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 12 ملغم / لتر عند 20 درجة مئوية |
| الذوبان | غير قابلة للذوبان في الإيثانول والأثير |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 10.4 |
| الرقم الهيدروجيني | 10.5 |
سلامة ومخاطر هيدروكسيد المغنيسيوم
يعتبر Mg(OH)2 آمنًا بشكل عام للتعامل والاستخدام، مع سمية منخفضة وليس له أي آثار مسرطنة معروفة. ومع ذلك، فإن التعرض لفترة طويلة لغبار أو مسحوق Mg(OH)2 يمكن أن يسبب تهيج الجهاز التنفسي وتلف الرئة. قد يسبب Mg(OH)2 أيضًا تهيجًا أو تآكلًا في العينين والجلد والأغشية المخاطية عند ملامسته. من المهم اتباع احتياطات السلامة المناسبة عند التعامل مع Mg(OH)2، مثل ارتداء معدات الحماية والعمل في منطقة جيدة التهوية. في حالة التلامس أو التعرض، اطلب العناية الطبية واشطف المناطق المصابة جيدًا بالماء.
| رموز الخطر | لا أحد |
| وصف الأمان | – تجنب استنشاقه وملامسته للعين والجلد والملابس. – ارتداء الملابس الواقية والقفازات وحماية العين / الوجه. – استخدام في منطقة جيدة التهوية. |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2826.90.90 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة. التعرض لفترات طويلة قد يسبب تهيج الجهاز التنفسي وتلف الرئة. |
طرق تصنيع هيدروكسيد المغنيسيوم
يمكن لطرق مختلفة تصنيع Mg(OH)2، مثل الترسيب، والتوليف الحراري المائي، والترسيب الكهروكيميائي.
تتضمن طريقة الترسيب تفاعل هيدروكسيد الصوديوم أو هيدروكسيد الأمونيوم مع كلوريد المغنيسيوم أو كبريتات المغنيسيوم لتكوين Mg(OH)2. ينتج عن التفاعل Mg(OH)2، والذي يمكن بعد ذلك جمعه وتجفيفه.
لإجراء التوليف الحراري المائي، يجب تسخين الماء إلى ضغط ودرجة حرارة مرتفعين مع إضافة أكسيد المغنيسيوم أو كربونات المغنيسيوم . ستنتج العملية Mg(OH)2 ويمكنك جمع البلورات عن طريق تبريد المحلول الناتج.
يتضمن الترسيب الكهروكيميائي تمرير تيار كهربائي عبر محلول أيونات المغنيسيوم، مما يؤدي إلى تفاعلها مع أيونات الهيدروكسيد وتكوين Mg(OH)2 على الكاثود.
تشمل الطرق الأخرى لتصنيع Mg(OH)2 استخدام أكسيد المغنسيوم وحليب الجير والتحلل الحراري لبيكربونات المغنسيوم.
ولكل طريقة مزاياها وعيوبها من حيث الفعالية والكفاءة والتكلفة. يعتمد اختيار طريقة التركيب على التطبيق المحدد والخصائص المطلوبة لمنتج Mg(OH)2.
استخدامات هيدروكسيد المغنيسيوم
يحتوي Mg(OH)2 على مجموعة واسعة من التطبيقات في مختلف الصناعات، بما في ذلك:
- مضاد للحموضة: يستخدم عادة كمضاد للحموضة لتحييد حمض المعدة وتخفيف حرقة المعدة وعسر الهضم وغيرها من المضايقات الهضمية.
- مثبطات اللهب: مثبطات لهب غير سامة تستخدم في البلاستيك والمطاط والمنسوجات لتقليل مخاطر الحريق.
- تعديل الرقم الهيدروجيني: يستخدم لضبط الرقم الهيدروجيني لمختلف المنتجات، بما في ذلك محاليل معالجة المياه ومستحضرات التجميل والمستحضرات الصيدلانية.
- المعالجة البيئية: تستخدم في معالجة مياه الصرف الصحي وتصريف المناجم الحمضية لتحييد الظروف الحمضية وإزالة المعادن الثقيلة.
- الأسمدة: يستخدم كسماد لتوفير المغنيسيوم للنباتات وتحسين درجة حموضة التربة.
- التطبيقات الطبية: يستخدم كملين، وفي بعض الإجراءات الطبية، مثل تنظير القولون، لتنظيف الأمعاء.
- تطبيقات أخرى: يستخدم كمثبت في طلاء اللاتكس، وكعامل تبييض في الورق، وكعامل تلميع في الزجاج والسيراميك.
أسئلة:
س: ما هي القاعدة المستخدمة في معجون الأسنان؟
ج: يستخدم Mg(OH)2 عادة كقاعدة في معاجين الأسنان للمساعدة في تحييد الحالات الحمضية في الفم وتقليل خطر تسوس الأسنان.
س: ما هي صيغة هيدروكسيد المغنيسيوم؟
ج: الصيغة الكيميائية لهيدروكسيد المغنيسيوم هي Mg(OH)2.
س: ما المعادلة الكيميائية التي توضح تفكك هيدروكسيد المغنيسيوم؟
ج: المعادلة الكيميائية لتفكك Mg(OH)2 هي
ملغم(OH)2 → ملغم2+ + 2OH-.
س: هل هيدروكسيد المغنيسيوم قابل للذوبان في الماء؟
ج: إن Mg(OH)2 قليل الذوبان في الماء، مما يعني أنه يذوب بدرجة محدودة للغاية.
س: أي المواد التالية يعتبر حمض أرهينيوس؟ BF3، HCN، NH3، Mg(OH)2؟
ج: لا تعتبر أي من المواد المذكورة من أحماض أرهينيوس. BF3 وHCN عبارة عن أحماض لويس، وNH3 قاعدة أرهينيوس ضعيفة، وMg(OH)2 قاعدة أرهينيوس قوية.
س: هل Mg(OH)2 قابل للذوبان في الماء؟
ج: إن Mg(OH)2 قليل الذوبان في الماء، مما يعني أنه يذوب بدرجة محدودة للغاية.
س: ما هي الكتلة المولية لـ Mg(OH)2؟
ج: تبلغ الكتلة المولية لـ Mg(OH)2 حوالي 58.32 جم/مول.
س: هل Mg(OH)2 حمض أم قاعدة؟
ج: يعتبر Mg(OH)2 قاعدة لأنه قادر على قبول أيونات الهيدروجين (البروتونات) لتكوين الماء والملح.
