فوسفات الكالسيوم (Ca3(PO4)2) هو معدن موجود في الأسنان والعظام. وهذا يساعد على جعلها قوية وصحية. كما أنه يستخدم كمكمل غذائي للوقاية من نقص الكالسيوم.
| اسم الأيوباك | فوسفات الكالسيوم |
| الصيغة الجزيئية | Ca3(PO4)2 |
| CAS رقم | 7758-87-4 |
| المرادفات | فوسفات ثلاثي الكالسيوم، فوسفات العظام، أورثوفوسفات الكالسيوم، فوسفات الكالسيوم تريباسيك، TCP |
| إنتشي | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
خصائص فوسفات الكالسيوم
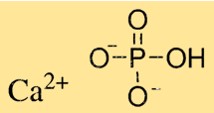
صيغة فوسفات الكالسيوم
الصيغة الكيميائية لفوسفات الكالسيوم هي Ca3(PO4)2، مما يدل على أنه يحتوي على ثلاثة أيونات الكالسيوم واثنين من أيونات الفوسفات. يتم استخدام الصيغة لحساب كمية فوسفات الكالسيوم اللازمة للتفاعلات الكيميائية. يعد فوسفات الكالسيوم مكونًا مهمًا للأسنان والعظام، ويستخدم أيضًا في التطبيقات الصناعية المختلفة، مثل المضافات الغذائية والأسمدة.
فوسفات الكالسيوم الكتلة المولية
الكتلة المولية لـ Ca3(PO4)2 هي 310.18 جم/مول. يتم حسابه عن طريق إضافة الكتلة الذرية للكالسيوم والفوسفور والأكسجين، وهي 40.08 جم / مول، 30.97 جم / مول و 15.99 جم / مول على التوالي. تعد الكتلة المولية معلمة مهمة في تحديد كمية Ca3(PO4)2 اللازمة في التفاعل الكيميائي.
نقطة غليان فوسفات الكالسيوم
ليس لدى Ca3(PO4)2 نقطة غليان محددة لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند تسخينه، يتحلل Ca3(PO4)2 إلى أكسيد الكالسيوم وخامس أكسيد الفوسفور، ويطلق بخار الماء. تعتمد درجة حرارة التحلل على نوع Ca3(PO4)2 ومعدل التسخين.
نقطة انصهار فوسفات الكالسيوم
تعتمد نقطة انصهار Ca3(PO4)2 على نوع Ca3(PO4)2. نقطة انصهار فوسفات ثلاثي الكالسيوم، الشكل الأكثر وفرة من Ca3(PO4)2 في الطبيعة، تبلغ حوالي 1670 درجة مئوية. يمتلك فوسفات ثنائي الكالسيوم نقطة انصهار تبلغ حوالي 1400 درجة مئوية، بينما يذوب فوسفات أحادي الكالسيوم عند حوالي 109 درجة مئوية.
كثافة فوسفات الكالسيوم جم / مل
تختلف كثافة Ca3(PO4)2 حسب نوع Ca3(PO4)2. تبلغ كثافة فوسفات ثلاثي الكالسيوم حوالي 3.14 جم / مل، بينما تبلغ كثافة فوسفات ثنائي الكالسيوم حوالي 2.31 جم / مل. تبلغ كثافة فوسفات أحادي الكالسيوم حوالي 2.22 جم / مل.
الوزن الجزيئي لفوسفات الكالسيوم
يبلغ الوزن الجزيئي لـ Ca3(PO4)2 310.18 جم/مول، وهو ما يتوافق مع مجموع الأوزان الذرية للكالسيوم والفوسفور والأكسجين. الوزن الجزيئي مهم لحساب كمية Ca3(PO4)2 اللازمة للتفاعلات الكيميائية.
هيكل فوسفات الكالسيوم
يحتوي Ca3(PO4)2 على بنية بلورية معقدة تعتمد على نوع Ca3(PO4)2. يحتوي فوسفات ثلاثي الكالسيوم على بنية بلورية سداسية، بينما يحتوي فوسفات ثنائي الكالسيوم على بنية بلورية أحادية الميل. يحتوي فوسفات أحادي الكالسيوم على بنية بلورية رباعية الزوايا. تتكون بلورات Ca3(PO4)2 من أيونات الكالسيوم وأيونات الفوسفات مرتبة في نمط معين.
| مظهر | مسحوق أبيض أو بلورات |
| جاذبية معينة | 3.14 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 310.18 جرام/مول |
| كثافة | 3.14 جم/مل (فوسفات ثلاثي الكالسيوم) |
| نقطة الانصهار | 1670 درجة مئوية (فوسفات ثلاثي الكالسيوم) |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | 0.002 جم/100 مل (عند 25 درجة مئوية) |
| الذوبان | قابل للذوبان في الأحماض، غير قابل للذوبان في الماء |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | pKa1: 1.9، pKa2: 6.7، pKa3: 12.0 |
| الرقم الهيدروجيني | 5.5-7.5 (10% معلق في الماء) |
سلامة ومخاطر فوسفات الكالسيوم
يعتبر Ca3(PO4)2 بشكل عام آمنًا للاستهلاك البشري ولا يشكل أي مخاطر صحية كبيرة. وهو معدن طبيعي موجود في العظام والأسنان ويستخدم كمكمل غذائي بأشكال عديدة. يستخدم Ca3(PO4)2 أيضًا في صناعة المواد الغذائية كمضاف للأغذية ومكيف للعجين. ومع ذلك، فإن الاستهلاك المفرط لمكملات Ca3(PO4)2 يمكن أن يؤدي إلى آثار ضارة، مثل اضطراب المعدة، والإمساك، وحتى تلف الكلى. بالإضافة إلى ذلك، فإن التعرض لمستويات عالية من غبار Ca3(PO4)2 في مكان العمل يمكن أن يسبب مشاكل في الجهاز التنفسي. لذلك، من المهم استخدام مكملات ومنتجات Ca3(PO4)2 باعتدال واتباع إرشادات السلامة الصناعية.
| رموز الخطر | لا شيء معروف |
| وصف الأمان | 26-36/37/39: ارتداء الملابس الواقية المناسبة والقفازات وحماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | لا يوجد |
| رمز النظام المنسق | 28352500 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة |
طرق تصنيع فوسفات الكالسيوم
هناك عدة طرق لتخليق الكالسيوم 3 (PO4) 2، بما في ذلك هطول الأمطار، والتوليف الحراري المائي، وعملية سول هلام، وتفاعل الحالة الصلبة.
تتضمن طريقة الترسيب جمع أيونات الكالسيوم والفوسفات في محلول مائي، مما يؤدي إلى تكوين راسب من خلال التفاعل الكيميائي. ثم يقوم المجرب بغسل وتجفيف الراسب للحصول على مركب Ca3(PO4)2 المطلوب.
يتضمن التوليف الحراري المائي تفاعل مصادر الكالسيوم والفوسفات في بيئة ذات ضغط مرتفع ودرجة حرارة عالية. للحصول على مركب Ca3(PO4)2 المطلوب، يتم غسل المنتج الناتج وتجفيفه.
في عملية sol-gel، يتم تحويل محلول sol أو معلق غرواني إلى هلام ثم يتم تجفيفه للحصول على مركب Ca3(PO4)2 المطلوب. تسمح هذه الطريقة بالتحكم الدقيق في تكوين وشكل المركب الذي تم الحصول عليه.
يتضمن تفاعل الحالة الصلبة خلط بيروفوسفات الكالسيوم وكربونات الكالسيوم في الحالة الصلبة ثم تسخين الخليط لتعزيز التفاعل الكيميائي. للحصول على مركب Ca3(PO4)2 المطلوب، يجب غسل المنتج الناتج وتجفيفه.
استخدامات فوسفات الكالسيوم
Ca3(PO4)2 له العديد من الاستخدامات في الصناعات المختلفة بسبب خصائصه الفريدة. بعض الاستخدامات الشائعة لـ Ca3(PO4)2 هي:
- المكملات الغذائية: يشيع استخدامها في المكملات الغذائية كمصدر للكالسيوم والفوسفور، وهما معادن ضرورية لصحة العظام.
- صناعة الأغذية والمشروبات: يستخدم كمادة مضافة للأغذية في العديد من الأطعمة المصنعة، بما في ذلك المخبوزات ومنتجات الألبان والمشروبات. في الخبز، يستخدمه الناس كعامل ترك ومصدر للكالسيوم.
- صناعة الأدوية: يستخدم في صناعة الأدوية كمادة حشو ومادة رابطة في الأقراص والكبسولات. يمكن لبعض الأدوية تحسين توافرها البيولوجي عن طريق استخدامها كعامل طلاء.
- الزراعة: يستخدم كسماد لتزويد النباتات بالعناصر الغذائية الأساسية مثل الكالسيوم والفوسفور.
- طب الأسنان: يستخدم في طب الأسنان لإعادة تمعدن الأسنان واستعادة مينا الأسنان.
- الهندسة الطبية الحيوية: تستخدم أيضًا في الهندسة الطبية الحيوية لتطوير بدائل الطعوم العظمية وتحسين خصائص المواد الحيوية المستخدمة في هندسة الأنسجة العظمية.
أسئلة:
س: لماذا يؤدي إضافة الحمض إلى زيادة ذوبان فوسفات الكالسيوم؟
ج: تؤدي إضافة الحمض إلى زيادة ذوبان Ca3(PO4)2 عن طريق بروتون أيونات الفوسفات، مما يجعلها أكثر قابلية للذوبان في الماء. تشكل أيونات الفوسفات البروتونية حمض Ca3(PO4)2، وهو أكثر قابلية للذوبان من الشكل المحايد.
س: كم جرام من الفوسفور يوجد في 500.0 جرام من فوسفات الكالسيوم؟
ج: الكتلة المولية لـ Ca3(PO4)2 هي 310.18 جم/مول. يحتوي المركب على نسبة الفوسفور/الكالسيوم 2:3، وبالتالي فإن الكتلة المولية للفوسفور هي 30.97 جم/مول. وبالتالي يوجد 81.62 جرامًا من الفوسفور في 500.0 جرامًا من Ca3(PO4)2.
س: هل فوسفات الكالسيوم قابل للذوبان؟
ج: يتميز Ca3(PO4)2 بقابلية منخفضة للذوبان في الماء، مع قابلية ذوبان المنتج تبلغ 1.8 × 10^-29. ومع ذلك، يمكن زيادة ذوبانه عن طريق إضافة الأحماض.
س: ما نسبة الأكسجين بالكتلة في فوسفات الكالسيوم؟
ج: الكتلة المولية لـ Ca3(PO4)2 هي 310.18 جم/مول. الكتلة الذرية للأكسجين هي 16.00 جم/مول ويوجد 8 ذرات أكسجين في مول واحد من Ca3(PO4)2. لذلك، فإن كتلة الأكسجين في مول واحد من Ca3(PO4)2 هي 8 × 16.00 = 128.00 جم. كتلة Ca3(PO4)2 هي 310.18 جم، وبالتالي فإن نسبة الأكسجين بالكتلة هي (128.00 جم / 310.18 جم) × 100% = 41.23%.
س: هل Ca3(PO4)2 قابل للذوبان في الماء؟
ج: Ca3(PO4)2 ليس شديد الذوبان في الماء، مع قابلية ذوبان المنتج تبلغ 1.3 × 10^-33.
س: ما هي الكتلة المولية لـ Ca3(PO4)2؟
ج: الكتلة المولية لـ Ca3(PO4)2 هي 310.18 جم/مول.
س: ما هو Ca3(PO4)2؟
ج: Ca3(PO4)2 مركب كيميائي يتكون من ثلاثة أيونات Ca2+ وأيونات PO43-. وهو مسحوق أبيض، عديم الرائحة وغير قابل للذوبان في الماء.
س: ما هي صيغة الكتلة بالجرام لـ Ca3(PO4)2؟
ج: الكتلة الصيغةية بالجرام لـ Ca3(PO4)2 هي 310.18 جم/مول.
