كربونات المغنيسيوم (MgCO3) هي مادة مسحوقية بيضاء تستخدم عادة كمضاد للحموضة وملين. ويوجد أيضًا في بعض مستحضرات التجميل ومعاجين الأسنان. تساعد كربونات المغنيسيوم على تحييد حمض المعدة الزائد وتخفيف الإمساك.
| اسم الأيوباك | كربونات المغنيسيوم |
| الصيغة الجزيئية | ملغم CO3 |
| CAS رقم | 546-93-0 |
| المرادفات | المغنسيت، مغنيسيا كاربونيكا، ملح المغنيسيوم، (MgCO3) |
| إنتشي | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
خصائص كربونات المغنيسيوم
صيغة كربونات المغنيسيوم
الصيغة الكيميائية لكربونات المغنيسيوم هي MgCO3. تشير هذه الصيغة إلى أن كربونات المغنيسيوم تحتوي على أيون Mg+2 واحد وأيون CO32- واحد. يتكون أيون CO3 2 من ذرة C واحدة وثلاث ذرات O. تعتبر الصيغة الكيميائية لكربونات المغنيسيوم خاصية مهمة لأنها تحدد تركيب كربونات المغنيسيوم والعناصر المكونة له.
كربونات المغنيسيوم الكتلة المولية
الكتلة المولية لـ MgCO3 هي 84.31 جم/مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية لذرات المغنيسيوم والكربون والأكسجين في مول واحد من MgCO3. تعد الكتلة المولية خاصية فيزيائية مهمة لـ MgCO3 لأنها تستخدم في حسابات مختلفة مثل تحديد عدد مولات MgCO3 في عينة معينة.
نقطة غليان كربونات المغنيسيوم
ليس لدى MgCO3 نقطة غليان محددة لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند تسخينه، يتحلل MgCO3 ليشكل أكسيد المغنيسيوم وثاني أكسيد الكربون. يحدث تحلل MgCO3 عند درجة حرارة حوالي 350 درجة مئوية.
نقطة انصهار كربونات المغنيسيوم
نقطة انصهار MgCO3 هي 990 درجة مئوية. عند درجة الحرارة هذه، يذوب MgCO3 ويتحلل ليشكل أكسيد المغنيسيوم وثاني أكسيد الكربون. تعد نقطة انصهار MgCO3 خاصية فيزيائية مهمة لأنها تحدد درجة الحرارة التي يمكن عندها ذوبان MgCO3 ومعالجتها.
كثافة كربونات المغنيسيوم جم/مل
تبلغ كثافة MgCO3 2.958 جم / مل. يتم الحصول على هذه القيمة عن طريق قسمة كتلة مول واحد من MgCO3 على حجمه. تعد كثافة MgCO3 خاصية فيزيائية مهمة لأنها تستخدم في تطبيقات مختلفة مثل تحديد طفو MgCO3 في محلول معين.
الوزن الجزيئي لكربونات المغنيسيوم
الوزن الجزيئي لـ MgCO3 هو 84.31 جم/مول. يتم الحصول على هذه القيمة عن طريق إضافة الكتل الذرية لذرات المغنيسيوم والكربون والأكسجين في جزيء MgCO3. يعد الوزن الجزيئي لـ MgCO3 خاصية فيزيائية مهمة لأنه يستخدم في حسابات مختلفة مثل تحديد كمية MgCO3 المطلوبة لتفاعل كيميائي معين.
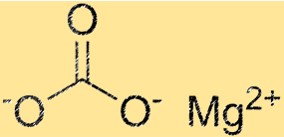
هيكل كربونات المغنيسيوم
يحتوي MgCO3 على بنية بلورية مثلثية. يقع أيون المغنيسيوم في وسط الهيكل ويحيط به ستة أيونات كربونات. يتم ترتيب أيونات الكربونات في نمط سداسي حول أيون المغنيسيوم. يعد التركيب البلوري لـ MgCO3 خاصية مهمة لأنه يحدد خصائصه الفيزيائية والكيميائية.
| مظهر | الصلبة البيضاء |
| كثافة محددة | 2,958 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 84.31 جرام/مول |
| كثافة | 2,958 جم/مل |
| نقطة الانصهار | 990 درجة مئوية |
| نقطة الغليان | يتحلل قبل الوصول إلى درجة الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 0.02 جم/لتر (15 درجة مئوية) |
| الذوبان | قابل للذوبان في الأحماض، غير قابل للذوبان في الماء |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 10.3 |
| الرقم الهيدروجيني | 9.2-10.2 |
سلامة ومخاطر كربونات المغنيسيوم
يعتبر MgCO3 مركبًا آمنًا. إنها ليست قابلة للاشتعال أو المتفجرة أو السامة. ومع ذلك، مثل أي مركب كيميائي آخر، يجب التعامل معه بحذر. استنشاق غبار MgCO3 قد يسبب تهيج الجهاز التنفسي. عند التعامل مع MgCO3، يوصى بارتداء معدات الحماية الشخصية المناسبة مثل القفازات ونظارات السلامة. يجب تخزين MgCO3 في مكان بارد وجاف، بعيدا عن مصادر الحرارة والاشتعال. يجب تنظيف MgCO3 المنسكب على الفور والتخلص منه بشكل صحيح. من المهم اتباع احتياطات السلامة المناسبة عند التعامل مع MgCO3 لتجنب أي مخاطر محتملة.
| رموز الخطر | لا أحد |
| وصف الأمان | لا تصنف على أنها خطيرة |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2836.60.00 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة، ولا تعتبر خطراً صحياً كبيراً عند التعامل معها بشكل صحيح |
طرق تصنيع كربونات المغنيسيوم
هناك عدة طرق لتصنيع MgCO3، بما في ذلك الترسيب والتحلل الحراري.
لتكوين MgCO3 باستخدام طريقة الترسيب، يمكنك إضافة ملح مغنيسيوم قابل للذوبان (مثل كلوريد المغنيسيوم أو نترات المغنيسيوم) إلى محلول يحتوي على كربونات قابلة للذوبان (مثل كربونات الصوديوم أو نترات المغنيسيوم). كربونات الأمونيوم). ثم حرك الخليط الناتج واتركه. يؤدي هذا إلى ترسيب MgCO3 خارج المحلول. بعد ذلك، تصفية الراسب، وغسله وتجفيفه.
للحصول على MgCO3 بطريقة التحلل الحراري، يتم تسخين هيدروكسيد المغنيسيوم أو أكسيد المغنيسيوم أثناء إدخال ثاني أكسيد الكربون. يؤدي هذا التفاعل إلى تكوين MgCO3 وبخار الماء. والخطوة التالية هي جمع وتنقية وتجفيف MgCO3.
هناك طريقة أخرى لتصنيع MgCO3 وهي تفاعل كبريتات المغنيسيوم وكربونات الصوديوم . يذيب الماء المركبين ثم يخلطهما، مما يؤدي إلى ترسيب MgCO3 خارج المحلول. تقوم العملية بعد ذلك بجمع الراسب وغسله وتجفيفه.
استخدامات كربونات المغنيسيوم
MgCO3 هو مركب متعدد الاستخدامات وله استخدامات مختلفة في صناعات مختلفة. وهذه بعض استخداماته:
- مكمل غذائي: يستخدم كمكمل غذائي لقدرته على تزويد الجسم بالمغنيسيوم الضروري.
- مضاد للحموضة: يستخدم كمضاد للحموضة لعلاج حرقة المعدة وعسر الهضم.
- التطبيقات الصناعية: يستخدم في العديد من التطبيقات الصناعية، مثل إنتاج السيراميك والزجاج والأسمنت.
- مستحضرات التجميل: تستخدم في مستحضرات التجميل كعامل منتفخ وماص ومعتم.
- مثبطات اللهب: تستخدم كمثبطات للهب في العديد من التطبيقات، بما في ذلك المواد العازلة والمنسوجات والبلاستيك.
- المستحضرات الصيدلانية: تستخدم في إنتاج المستحضرات الصيدلانية المختلفة، مثل الملينات ومضادات الحموضة.
- صناعة المواد الغذائية: يستخدم كمضاف غذائي لتنظيم حموضة المنتجات الغذائية وكعامل مضاد للتكتل.
- المعدات الرياضية: تستخدم في المعدات الرياضية، مثل طباشير الصالة الرياضية، لتحسين القبضة ومنع الانزلاق.
أسئلة:
س: هل كربونات المغنيسيوم قابلة للذوبان في الماء؟
ج: إن MgCO3 ذو قابلية منخفضة للذوبان في الماء. في درجة حرارة الغرفة، يمكن أن يذوب حوالي 0.02 جرام فقط من MgCO3 في 100 مل من الماء.
س: هل MgCO3 قابل للذوبان؟
ج: يتمتع MgCO3 بقابلية منخفضة للذوبان في الماء، مما يعني أنه غير قابل للذوبان بدرجة كبيرة.
س: ماذا يتكون عند تفاعل حمض الأسيتيك مع MgCO3؟
ج: عندما يتفاعل حمض الأسيتيك مع MgCO3، فإنهما يشكلان خلات المغنيسيوم والماء وثاني أكسيد الكربون. المعادلة الكيميائية المتوازنة لهذا التفاعل هي MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
س: الذوبان المولي لـ MgCO3 هو 1.8 × 10–4 مول/لتر. ما هو Ksp لهذا المركب؟
ج: قيمة Ksp لـ MgCO3 باستخدام الذوبان المولي:
Ksp = [Mg2+][CO32-]، حيث [Mg2+] يساوي الذوبان المولي، و[CO32-] يساوي أيضًا الذوبان المولي. ولذلك، Ksp = (1.8 × 10–4 مول/لتر)2 = 3.24 × 10–9.
س: أي مما يلي يعد منتجًا يتكون أثناء تحلل MgCO3؟
ج: عندما يتحلل MgCO3، فإنه يشكل أكسيد المغنيسيوم (MgO) وثاني أكسيد الكربون (CO2).
س: ما هي المعادلة الكيميائية الموزونة للتفاعل المستخدم لحساب ΔH°f من MgCO3(s)؟
ج: المعادلة الكيميائية المتوازنة للتفاعل المستخدم لحساب المحتوى الحراري القياسي للتكوين (ΔH°f) لـ MgCO3(s) هي: Mg(s) + CO2(g) → MgCO3(s).
