بيروكسيد الصوديوم (Na2O2) هو عامل مؤكسد قوي. يتفاعل بعنف مع الماء ليطلق الأكسجين ويمكن أن يشعل مواد قابلة للاحتراق عند ملامستها. يتم استخدامه في التفاعلات الكيميائية المختلفة وكمطهر.
| اسم الأيوباك | أكسيد الصوديوم |
| الصيغة الجزيئية | Na2O2 |
| CAS رقم | 1313-60-6 |
| المرادفات | بيروكسيد الصوديوم، فوق أكسيد الصوديوم، ثاني أكسيد الصوديوم، ثاني أكسيد الصوديوم، ثاني أكسيد الصوديوم، NaO2، الأمم المتحدة 1507 |
| إنتشي | InChI=1S/2Na.O2/c;;1-2/q2*+1;-2 |
خصائص بيروكسيد الصوديوم
صيغة بيروكسيد الصوديوم
الصيغة الكيميائية لبيروكسيد الصوديوم هي Na2O2. وهو مركب أيوني يتكون من كاتيونين صوديوم (Na+) وأنيون بيروكسيد (O22-). تُستخدم صيغة بيروكسيد الصوديوم لتمثيل التركيب الكيميائي للمركب وهي مهمة في التفاعلات الكيميائية التي تتضمن المادة.
الكتلة المولية من بيروكسيد الصوديوم
بيروكسيد الصوديوم، الصيغة الكيميائية Na2O2، لديه كتلة مولية قدرها 77.98 جم / مول. وهو مركب أيوني يتكون من كاتيونين صوديوم (Na+) وأنيون بيروكسيد (O22-). تعتبر الكتلة المولية لبيروكسيد الصوديوم ضرورية لحساب كمية المركب اللازمة للتفاعلات الكيميائية المختلفة.
نقطة غليان بيروكسيد الصوديوم
يحتوي بيروكسيد الصوديوم على نقطة غليان عالية جدًا تبلغ 657 درجة مئوية (1215 درجة فهرنهايت)، مما يجعله مستقرًا للغاية عند درجات الحرارة المرتفعة. يتحلل المركب قبل أن يصل إلى نقطة الغليان، ويطلق غاز الأكسجين ويترك وراءه أكسيد الصوديوم. نقطة الغليان العالية لبيروكسيد الصوديوم تجعله مفيدًا في تفاعلات درجات الحرارة المرتفعة والعمليات الصناعية التي تتطلب ثباتًا حراريًا عاليًا.
نقطة انصهار بيروكسيد الصوديوم
يحتوي بيروكسيد الصوديوم على نقطة انصهار تبلغ 675 درجة مئوية (1247 درجة فهرنهايت)، وهي مرتفعة نسبيًا مقارنة بالمواد الشائعة الأخرى. ينصهر ليكوّن سائلًا أبيض مصفرًا ويتحلل فوق نقطة انصهاره ليطلق غاز الأكسجين ويكوّن أكسيد الصوديوم. نقطة الانصهار العالية لبيروكسيد الصوديوم تجعله مفيدًا في التفاعلات الكيميائية عند درجات حرارة عالية.
كثافة بيروكسيد الصوديوم جم/مل
تبلغ كثافة بيروكسيد الصوديوم 2.805 جم/مل. وهو مسحوق أبيض إلى مصفر كثافته أكبر من كثافة الماء. الكثافة العالية لبيروكسيد الصوديوم تجعله مفيدًا في العمليات الصناعية المختلفة مثل التبييض والتطهير وإنتاج المواد الكيميائية الأخرى.
الوزن الجزيئي لبيروكسيد الصوديوم
بيروكسيد الصوديوم لديه الوزن الجزيئي 77.98 جم / مول. وهو مركب أيوني يحتوي على كاتيونين صوديوم (Na+) وأنيون بيروكسيد واحد (O22-). يعد الوزن الجزيئي لبيروكسيد الصوديوم مهمًا في التفاعلات الكيميائية التي تتضمن المركب لأنه يساعد في تحديد كميات المواد المتفاعلة والمنتجات.
هيكل بيروكسيد الصوديوم
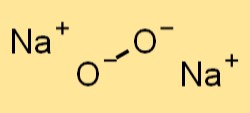
يحتوي بيروكسيد الصوديوم على بنية بلورية مشابهة لكلوريد الصوديوم (NaCl). وهو يشكل شبكة مكعبة مركزية الوجه، حيث تشغل أيونات الصوديوم زوايا المكعب وتقع أنيونات البيروكسيد في وسط كل وجه. ترتبط أنيونات البيروكسيد الموجودة في بيروكسيد الصوديوم معًا بواسطة روابط تساهمية، بينما ترتبط أيونات الصوديوم معًا بواسطة روابط أيونية.
| مظهر: | الأبيض إلى مسحوق مصفر |
| جاذبية معينة: | 2,805 جم/سم3 |
| لون: | أبيض إلى مصفر |
| يشم: | عديم الرائحة |
| الكتلة المولية: | 77.98 جرام/مول |
| كثافة: | 2,805 جم/سم3 |
| نقطة الانصهار: | 675 درجة مئوية (1247 درجة فهرنهايت) |
| نقطة الغليان: | 657 درجة مئوية (1215 درجة فهرنهايت) |
| نقطة الوميض: | غير قابل للتطبيق |
| الذوبان في الماء: | يتفاعل بعنف مع الماء |
| الذوبان: | قابل للذوبان في الكحول والأثير |
| ضغط البخار: | غير قابل للتطبيق |
| كثافة بخار: | غير قابل للتطبيق |
| pKa: | غير قابل للتطبيق |
| الرقم الهيدروجيني: | غير قابل للتطبيق |
السلامة ومخاطر بيروكسيد الصوديوم
| رموز الخطر: | المؤكسدة والتآكل |
| وصف الأمان: | لا تتنفس الغبار/الأبخرة/الغاز/الضباب/الأبخرة. تجنب ملامسة الجلد/العينين. التعامل مع وتخزينها تحت غاز خامل. في حالة ملامسة العينين، اغسلها فورًا بكمية كبيرة من الماء واشطفها بالطبيب. في حالة نشوب حريق، استخدم وسائل الإطفاء المناسبة. |
| أرقام تعريف الأمم المتحدة: | UN1503 |
| رمز النظام المنسق: | 2829.11.00 |
| فئة الخطر: | 5.1 |
| مجموعة التعبئة: | ثانيا |
| تسمم: | تآكل للعينين والجلد، وهو ضار إذا تم ابتلاعه أو استنشاقه. |
طرق تصنيع بيروكسيد الصوديوم
يمكن تصنيع بيروكسيد الصوديوم (Na2O2) من خلال عدة طرق، مثل الجمع المباشر، والتفاعل مع الأكسجين، والتحليل الكهربائي.
إحدى طرق تصنيع Na2O2 هي طريقة التركيب المباشر. يتضمن ذلك تسخين معدن الصوديوم مع الأكسجين الزائد في الفرن. التفاعل طارد للحرارة ومن الضروري تنظيم درجة الحرارة لتجنب ارتفاع درجة الحرارة واحتمال الانفجار.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد الصوديوم مع بيروكسيد الهيدروجين لإنتاج Na2O2 والماء. تعتبر هذه الطريقة أكثر أمانًا وأكثر تحكمًا من طريقة التركيب المباشر ولكنها تتطلب درجة حرارة أعلى ووقت تفاعل أطول.
طريقة أخرى لتركيب Na2O2 هي من خلال التحليل الكهربائي. يتضمن ذلك التحليل الكهربائي لمحلول هيدروكسيد الصوديوم باستخدام أنود وكاثود مناسبين. أثناء التحليل الكهربائي، ينتج الكاثود Na2O2، بينما ينتج الأنود غاز الأكسجين.
استخدامات بيروكسيد الصوديوم
يجد بيروكسيد الصوديوم العديد من التطبيقات الصناعية والمخبرية بسبب خصائصه المؤكسدة وقدرته على إطلاق الأكسجين.
فيما يلي بعض الاستخدامات الشائعة لبيروكسيد الصوديوم:
- التبييض: يستخدم كعامل تبييض لب الورق والمنسوجات وغيرها من المواد.
- عامل إزالة الروائح الكريهة: يستخدم كعامل إزالة الروائح الكريهة في مرافق التخلص من النفايات ومعالجة مياه الصرف الصحي.
- عامل مؤكسد: يستخدم لأكسدة المركبات العضوية وغير العضوية المختلفة.
- البلمرة: بدء بلمرة بعض المونومرات. تستخدم في إنتاج رغوة البولي يوريثان والبوليمرات الأخرى.
- التطبيقات الصيدلانية: يستخدم ككاشف في تركيب المركبات الصيدلانية.
- الكاشف المختبري: يستخدم ككاشف مختبري لأغراض تحليلية وصناعية مختلفة.
- تطبيقات خلايا الوقود: تستخدم كمؤكسد في خلايا الوقود لتوليد الطاقة الكهربائية.
أسئلة:
س: ما هو التفاعل الكيميائي بين بيروكسيد الهيدروجين وثنائي كبريتيت الصوديوم؟
ج: التفاعل الكيميائي بين بيروكسيد الهيدروجين وثنائي كبريتيت الصوديوم ينتج عنه ماء وكبريتات الصوديوم. المعادلة المتوازنة للتفاعل هي: 2 NaHSO3 + H2O2 → Na2SO4 + 2 H2O.
س: أين يمكن شراء مسحوق بيروكسيد الصوديوم؟
ج: يمكن شراء مسحوق بيروكسيد الصوديوم من موردي وموزعي المواد الكيميائية المختلفين. من المهم التأكد من أن المورد يتمتع بسمعة طيبة ويتبع بروتوكولات السلامة المناسبة للتعامل مع المواد الكيميائية الخطرة وشحنها.
س: هل يمكن تحويل أكسيد الصوديوم إلى بوروهيدريد وبيروكسيد الهيدروجين؟
ج: لا يمكن تصنيع أكسيد الصوديوم مباشرة من البوروهيدريد وبيروكسيد الهيدروجين. يمكن تصنيع أكسيد الصوديوم عن طريق تفاعل معدن الصوديوم مع الأكسجين أو عن طريق تسخين هيدروكسيد الصوديوم. لا يستخدم البوروهيدريد وبيروكسيد الهيدروجين بشكل شائع في تصنيع أكسيد الصوديوم.
س: ما هي صيغة بيروكسيد الصوديوم؟
ج: صيغة بيروكسيد الصوديوم هي Na2O2.
س: ما هي حالة أكسدة Na2O2؟
ج: حالة أكسدة الصوديوم في Na2O2 هي +1 وحالة أكسدة الأكسجين هي -1.
س: ما هو عدد تأكسد الأكسجين في مركب Na2O2؟
ج: عدد تأكسد الأكسجين في مركب Na2O2 هو -1.
