نترات الكالسيوم مركب كيميائي له الصيغة Ca(NO3)2. وهي مادة صلبة عديمة اللون والرائحة وقابلة للذوبان في الماء بدرجة كبيرة. ويشيع استخدام نترات الكالسيوم كسماد وفي معالجة مياه الصرف الصحي. كما أنه يستخدم في إنتاج الخرسانة، كأحد مكونات المتفجرات وفي صناعة المواد الكيميائية المختلفة الأخرى.
| اسم الأيوباك | ثنائي نترات الكالسيوم |
| الصيغة الجزيئية | كا(NO3)2 |
| CAS رقم | 10124-37-5 |
| المرادفات | نترات الكالسيوم رباعي هيدرات، ملح الكالسيوم لحمض النيتريك، نيتروكالسيت، الملح الصخري النرويجي، ملح الليمون الحامض، نورجيسالبيتر |
| إنتشي | إنتشي = 1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
صيغة نترات الكالسيوم
صيغة نترات الكالسيوم هي Ca(NO3)2. وهذا يعني أن كل وحدة من نترات الكالسيوم تحتوي على أيون كالسيوم واحد (Ca²⁺) وأيوني نترات (NO3⁻). غالبًا ما تستخدم صيغة نترات الكالسيوم لتحديد الكتلة المولية والخصائص الأخرى للمركب.
نترات الكالسيوم الكتلة المولية
نترات الكالسيوم لديها كتلة مولية تبلغ 164.088 جم / مول. وهو ملح يتكون من أيونات Ca+2 وNO3-، وصيغته Ca(NO3)2. الكتلة المولية للمركب هي الكتلة بالجرام لمول واحد من مركب الصيغة هذا، وهو ما يساوي وزنه. في حالة Ca(NO3)2، صيغة الوزن هي مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب.
درجة غليان نترات الكالسيوم
يحتوي Ca(NO3)2 على نقطة غليان عالية نسبيًا تبلغ 132 درجة مئوية. وهذا يعني أن الأمر يتطلب كمية كبيرة من الطاقة لتحويل المركب الصلب إلى غاز. ترجع نقطة الغليان العالية لـ Ca(NO3)2 إلى طبيعته الأيونية، مما يؤدي إلى تفاعلات كهروستاتيكية قوية بين أيونات Ca+2 وNO3-.
نقطة انصهار نترات الكالسيوم
درجة انصهار Ca(NO3)2 هي 561 درجة مئوية. وهذا مرتفع نسبيًا بالنسبة للملح، ويعكس مرة أخرى التفاعلات الأيونية القوية بين أيونات Ca+2 وNO3-. نقطة انصهار Ca(NO3)2 تجعله مركبًا مفيدًا لتطبيقات درجات الحرارة المرتفعة، كما هو الحال في صناعة الأسمدة أو المتفجرات.
كثافة نترات الكالسيوم جم/مل
تختلف كثافة Ca(NO3)2 حسب شكلها. على سبيل المثال، تبلغ كثافة Ca(NO3)2 اللامائية حوالي 2.5 جم/سم3، بينما تبلغ كثافة رباعي الهيدرات (Ca(NO3)2.4H2O) حوالي 1.82 جم/سم3. هذه القيم تجعل Ca(NO3)2 مركبًا كثيفًا نسبيًا مقارنة بالعديد من الأملاح الأخرى.
الوزن الجزيئي لنترات الكالسيوم
الوزن الجزيئي لـ Ca(NO3)2 هو 164.088 جم/مول. هذه القيمة هي مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب، والذي يتضمن ذرتي نيتروجين وست ذرات أكسجين وذرة كالسيوم واحدة.
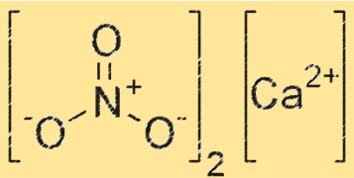
هيكل نترات الكالسيوم
يحتوي Ca(NO3)2 على بنية أيونية، حيث أن أيون الكالسيوم (Ca²⁺) محاط بست ذرات أكسجين في ترتيب ثماني السطوح. يوجد أيون NO3- أيضًا في الشبكة البلورية، حيث تشكل كل ذرة أكسجين في أيون NO3- رابطة تنسيق مع أيون Ca+2. يشبه هيكل Ca(NO3)2 تركيب المركبات الأيونية الأخرى، مثل كلوريد الصوديوم.
| مظهر | بلورات بيضاء أو مسحوق |
| جاذبية معينة | 2.5 (لا مائي)؛ 1.82 (رباعي الهيدرات) |
| لون | عديم اللون (اللامائي)؛ أبيض (رباعي الهيدرات) |
| يشم | عديم الرائحة |
| الكتلة المولية | 164,088 جم/مول |
| كثافة | 2.5 جم/سم3 (لا مائي)؛ 1.82 جم/سم3 (رباعي هيدرات) |
| نقطة الانصهار | 561 درجة مئوية (لا مائي)؛ 45 درجة مئوية (رباعي هيدرات) |
| نقطة الغليان | 132 درجة مئوية (تتحلل) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 121.2 جم/100 مل (0 درجة مئوية)؛ 126.7 جم/100 مل (20 درجة مئوية)؛ 179.6 جم/100 مل (100 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء والإيثانول والميثانول |
| ضغط البخار | ضئيل (لا مائي) |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | 4.5-7.5 (محلول 10%) |
سلامة ومخاطر نترات الكالسيوم
يمكن أن تشكل نترات الكالسيوم (Ca(NO3)2) العديد من المخاطر إذا لم يتم التعامل معها بشكل صحيح. وهو عامل مؤكسد قوي يمكن أن يسبب حريقًا أو انفجارًا إذا لامس مواد قابلة للاحتراق. قد يسبب المركب أيضًا تهيجًا للجلد والعين عند ملامسته، كما أن استنشاق الغبار قد يسبب تهيج الجهاز التنفسي. يجب تخزين Ca(NO3)2 في مكان بارد وجاف بعيداً عن مصادر الحرارة، ويجب عدم خلطه مع مواد كيميائية أخرى دون اتخاذ الاحتياطات المناسبة. يجب ارتداء معدات الحماية الشخصية مثل القفازات وحماية العين عند التعامل مع Ca(NO3)2 لتجنب ملامسة الجلد أو العينين. في حالة الابتلاع العرضي، يجب طلب العناية الطبية على الفور.
| رموز الخطر | عامل مؤكسد (GHS05)، مهيج (GHS07) |
| وصف الأمان | S22: لا تتنفس الغبار/الأبخرة/الغاز/الضباب/الأبخرة/الهباء الجوي. S26: في حالة ملامسة العينين، اشطفهما فورًا بالكثير من الماء واستشر الطبيب. S36/37/39: ارتد الملابس الواقية المناسبة والقفازات وأدوات حماية العين/الوجه. |
| معرفات | UN1454 (نترات الكالسيوم اللامائية)، UN1455 (رباعي هيدرات نترات الكالسيوم) |
| رمز النظام المنسق | 283429 |
| فئة الخطر | 5.1 (العوامل المؤكسدة) |
| مجموعة التعبئة | ثالثا |
| تسمم | عن طريق الفم (LD50): 3420 ملغم/كغم (الفئران)؛ عن طريق الجلد (LD50): > 5000 ملغم/كغم (الأرنب)؛ الاستنشاق (LC50): >4.8 ملغم/لتر/4 ساعات (الجرذ) |
طرق تصنيع نترات الكالسيوم
هناك طرق مختلفة لتصنيع Ca(NO3)2 اعتمادًا على التطبيق المحدد والنقاء المطلوب.
الطريقة الشائعة هي تفاعل كربونات الكالسيوم مع حمض النيتريك لإنتاج Ca(NO3)2 وثاني أكسيد الكربون:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
هناك طريقة أخرى وهي تفاعل هيدروكسيد الكالسيوم مع حمض النيتريك :
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
التفاعل بين حمض النيتريك وأكسيد الكالسيوم يعطي الكالسيوم (NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
يمكن تنقية Ca(NO3)2 الناتج بشكل إضافي عن طريق إعادة البلورة أو عن طريق إضافة كمية صغيرة من حمض الكبريتيك لإزالة الشوائب مثل الحديد والألومنيوم.
يمكن للمصنعين إنتاج Ca(NO3)2 عن طريق تفاعل معدن الكالسيوم مع حمض النيتريك أو عن طريق تفاعل هيدروكسيد الكالسيوم مع نترات الأمونيوم. ومع ذلك، فإنهم يستخدمون هذه الطرق بشكل أقل شيوعًا بسبب ارتفاع التكلفة أو مخاوف السلامة المرتبطة بالمعادن التفاعلية أو نترات الأمونيوم.
استخدامات نترات الكالسيوم
- يستخدم كسماد في الزراعة لتزويد النباتات بمغذيات الكالسيوم والنيتروجين اللازمة للنمو.
- يستخدم كمكون في عدة أنواع من الخرسانة والأسمنت لتحسين قوتها ومتانتها.
- يستخدم كمادة مضافة في إنتاج المواد الكيميائية لمعالجة مياه الصرف الصحي للمساعدة في إزالة مركبات الفوسفور والنيتروجين من الماء.
- يستخدم في إنتاج عدة أنواع من المتفجرات والألعاب النارية بسبب خصائصه المؤكسدة.
- يستخدم كمصدر للكالسيوم والنيتروجين في إنتاج المواد الكيميائية المختلفة مثل النايلون والألياف الصناعية الأخرى.
- يستخدم كمثبط للتآكل للمعادن مثل الألومنيوم والصلب في التطبيقات الصناعية.
- يستخدم في حفظ اللحوم وكمضاف غذائي لتحسين جودة بعض المنتجات الغذائية.
- تستخدم في إنتاج قنابل الدخان والمشاعل للتطبيقات العسكرية والمدنية.
- يستخدم في صناعة بعض الأسمدة. يستخدم أيضًا مع مركبات أخرى لتوفير إمدادات متوازنة من العناصر الغذائية للمحاصيل.
- يستخدم كمكون في بعض الأسمدة المتخصصة في أحواض السمك لتوفير العناصر الغذائية الأساسية للنباتات المائية.
أسئلة:
س: ما اسم Ca(NO3)2؟
ج: اسم Ca(NO3)2 هو نترات الكالسيوم.
س: هل الكالسيوم (NO3)2 قابل للذوبان في الماء؟
ج: نعم، Ca(NO3)2 قابل للذوبان بدرجة عالية في الماء. في درجة حرارة الغرفة، يمكن لـ 100 جرام من الماء أن يذيب ما يصل إلى 121 جرامًا من نترات الكالسيوم.
س: أين يمكن شراء نترات الكالسيوم؟
ج: يمكن شراء Ca(NO3)2 من موردي المواد الكيميائية المختلفين عبر الإنترنت وفي المتاجر. تشمل بعض الأماكن الشائعة لشراء Ca(NO3)2 شركات الإمدادات العلمية، ومتاجر مستلزمات المزارع، ومراكز المنزل والحديقة. من المهم التأكد من أن المورد يتمتع بسمعة طيبة وأن المنتج ذو جودة عالية ومناسب للتطبيق المقصود.
