كلوريد الأمونيوم أو NH4Cl هو ملح بلوري أبيض يستخدم في تطبيقات مختلفة، بما في ذلك الطب والأسمدة. ويتكون من تفاعل الأمونيا وحمض الهيدروكلوريك وله طعم مالح مميز.
| اسم الأيوباك | كلوريد الأمونيوم |
| الصيغة الجزيئية | NH4Cl |
| CAS رقم | 12125-02-9 |
| المرادفات | سال أمونيا، سالمياك، ملح نوشادير، أمكلور، سال أرمانياك، هيدروكلوريت، موريات الأمونيوم، سال أرمانياك |
| إنتشي | InChI=1S/ClH.H3N/h1H;1H3 |
NH4Cl الكتلة المولية
يحتوي كلوريد الأمونيوم على كتلة مولية قدرها 53.49 جم/مول. تشير الكتلة المولية إلى كتلة مول واحد من المادة ويتم التعبير عنها بالجرام لكل مول (جم/مول). يتم تحديد الكتلة المولية لكلوريد الأمونيوم عن طريق إضافة الكتل الذرية للذرات المكونة له، وهي النيتروجين (N)، الهيدروجين (H)، والكلور (Cl). الصيغة الجزيئية لكلوريد الأمونيوم هي NH4Cl، مما يعني أنه يحتوي على ذرة نيتروجين واحدة، وأربع ذرات هيدروجين، وذرة واحدة من الكلور. ولذلك، يمكن حساب الكتلة المولية لكلوريد الأمونيوم على النحو التالي
الكتلة المولية = (1 × الكتلة الذرية لـ N) + (4 × الكتلة الذرية لـ H) + (1 × الكتلة الذرية لـ Cl)
= (1 × 14.01 جم / مول) + (4 × 1.01 جم / مول) + (1 × 35.45 جم / مول)
= 53.49 جم/مول
نقطة غليان كلوريد الأمونيوم
نقطة غليان كلوريد الأمونيوم هي 520 درجة مئوية (968 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي يكون عندها ضغط بخار السائل مساوياً للضغط الخارجي المطبق عليه. عند درجة الحرارة هذه، يتبخر كلوريد الأمونيوم ويتحول إلى الحالة الغازية. ترجع نقطة الغليان العالية لكلوريد الأمونيوم إلى الروابط الأيونية القوية بين أيونات الأمونيوم (NH4+) والكلوريد (Cl-).
نقطة انصهار كلوريد الأمونيوم
نقطة انصهار كلوريد الأمونيوم هي 338 درجة مئوية (640 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى سائل. عند درجة الحرارة هذه، تنكسر الروابط الأيونية بين أيونات الأمونيوم (NH4+) وأيونات الكلوريد (Cl-) ويتغير كلوريد الأمونيوم من الحالة الصلبة إلى الحالة السائلة. يتمتع كلوريد الأمونيوم بنقطة انصهار منخفضة نسبيًا مقارنة بالمركبات الأيونية الأخرى، مما يجعله مفيدًا في بعض التطبيقات مثل اللحام والتعدين.
كثافة كلوريد الأمونيوم جم/مل
تبلغ كثافة كلوريد الأمونيوم 1.527 جم/سم3. الكثافة هي مقياس لكمية الكتلة لكل وحدة حجم من المادة. تعود الكثافة العالية لكلوريد الأمونيوم إلى بنيته الشبكية الأيونية المدمجة للغاية. كلوريد الأمونيوم له كثافة أعلى من الماء، مما يعني أنه سوف يغوص في الماء.
الوزن الجزيئي لكلوريد الأمونيوم
الوزن الجزيئي لكلوريد الأمونيوم هو 53.49 جم / مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. الوزن الجزيئي لكلوريد الأمونيوم هو نفس كتلته المولية.
هيكل كلوريد الأمونيوم
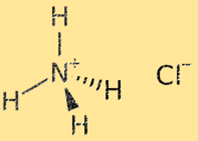
هيكل كلوريد الأمونيوم عبارة عن شبكة بلورية تتكون من أيونات الأمونيوم (NH4+) والكلوريد (Cl-) بالتناوب. أيون الأمونيوم هو أيون متعدد الذرات ذو شحنة موجبة (+1)، ويتكون من ذرة نيتروجين واحدة وأربع ذرات هيدروجين. أيون الكلوريد هو أيون أحادي الذرة بشحنة سالبة (-1)، ويتكون من ذرة الكلور. يتم تثبيت بنية الشبكة البلورية لكلوريد الأمونيوم بواسطة روابط أيونية قوية بين أيونات الأمونيوم والكلوريد، مما يؤدي إلى مادة صلبة مستقرة للغاية وهشة.
صيغة كلوريد الأمونيوم
صيغة كلوريد الأمونيوم هي NH4Cl. ويتكون من أيون الأمونيوم (NH4+) وأيون الكلوريد (Cl-). تمثل الصيغة نسبة الذرات في الجزيء، وتظهر أنه مقابل كل أيون أمونيوم، هناك أيون كلوريد واحد. تُستخدم صيغة كلوريد الأمونيوم لتحديد الكتلة المولية والكثافة والخصائص الأخرى للمركب.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1,527 جرام/سم3 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 53.49 جرام/مول |
| كثافة | 1,527 جرام/سم3 |
| نقطة الانصهار | 338 درجة مئوية (640 درجة فهرنهايت) |
| نقطة الغليان | 520 درجة مئوية (968 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 29.7 جم/100 مل (25 درجة مئوية) |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| PKa | 9:25 صباحًا |
| الرقم الهيدروجيني | 4.6 (محلول 5%) |
سلامة ومخاطر كلوريد الأمونيوم
يعتبر كلوريد الأمونيوم (NH4Cl) آمنًا للاستخدام العادي بشكل عام. ومع ذلك، يمكن أن يكون ضارًا إذا تم تناوله أو استنشاقه بكميات كبيرة. قد يسبب تناول NH4Cl تهيج الفم والحلق والغثيان والقيء والإسهال. قد يؤدي استنشاق NH4Cl إلى تهيج الجهاز التنفسي والسعال وضيق التنفس. يجب التعامل مع NH4Cl بحذر، لأنه يمكن أن يسبب تهيج الجلد والعين. ومن المهم أيضًا تجنب التعرض لغبار أو بخار NH4Cl، الذي يمكن أن يكون مهيجًا للعينين والأنف والحنجرة. يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع NH4Cl.
| رموز الخطر | الحادي عشر |
| وصف الأمان | S22، S24/25، S36/37/39 |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 3077 |
| رمز النظام المنسق | 2827.10.00 |
| فئة الخطر | 9- البضائع الخطرة المتنوعة |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة، ولكنها قد تكون ضارة إذا تم ابتلاعها أو استنشاقها بكميات كبيرة. |
طرق تصنيع كلوريد الأمونيوم
يمكن تصنيع كلوريد الأمونيوم (NH4Cl) بطرق مختلفة.
- الطريقة الشائعة هي تفاعل غاز الأمونيا مع حمض الهيدروكلوريك في الماء. ينتج هذا التفاعل الطارد للحرارة NH4Cl على شكل مادة صلبة بلورية بيضاء. من المهم إضافة حمض الهيدروكلوريك إلى الماء ببطء مع التحريك لتجنب تناثره من الحرارة المتولدة.
- طريقة أخرى لإنتاج NH4Cl هي كمنتج ثانوي لعمليات صناعية مختلفة مثل إنتاج كربونات الصوديوم أو عملية سولفاي.
- هناك طريقة أخرى لتصنيع NH4Cl وهي تفاعل الأمونيا مع كلوريد الصوديوم. ينتج عن هذا التفاعل كلا من NH4Cl وهيدروكسيد الصوديوم. هذا التفاعل طارد للحرارة ويتطلب تحكمًا دقيقًا لتجنب تكوين منتجات ثانوية غير مرغوب فيها.
استخدامات كلوريد الأمونيوم
كلوريد الأمونيوم (NH4Cl) له العديد من الاستخدامات في الصناعات المختلفة.
- يعمل NH4Cl كسماد في الزراعة، حيث يوفر العناصر الغذائية الأساسية للمحاصيل مثل النيتروجين والكلوريد، وبالتالي تحسين الإنتاجية والجودة.
- يسهل كلوريد الأمونيوم الأداء السليم للخلايا الجافة عن طريق توصيل الكهرباء ككهارل.
- تستخدم صناعة النسيج NH4Cl كعامل للصباغة والطباعة، مما يساعد على تثبيت الأصباغ على الأقمشة وتحسين ثبات اللون.
- كتدفق في تشغيل المعادن واللحام، يزيل NH4Cl طبقات الأكسيد من المعادن، مما يسمح بعملية لحام أسهل.
- ولهذه المادة الكيميائية تطبيقات في الأغذية والأدوية ومستحضرات التجميل كعامل منكه وطارد للبلغم في أدوية السعال ومكون في منتجات العناية الشخصية.
بشكل عام، فإن الخصائص الفريدة لـ NH4Cl تجعله مادة كيميائية متعددة الاستخدامات ولها العديد من التطبيقات المهمة في مختلف الصناعات.
أسئلة:
س: هل كلوريد الأمونيوم سامية؟
ج: نعم، من المعروف أن كلوريد الأمونيوم يتسامي، مما يعني أنه يمكن أن ينتقل مباشرة من الحالة الصلبة إلى الحالة الغازية دون أن ينصهر بينهما.
س: هل NH4Cl حمضي أم قاعدي؟
ج: كلوريد الأمونيوم ملح حمضي. عندما يذوب في الماء، يمكن أن يخضع للتحلل المائي لإنتاج محلول حمضي. وذلك لأن أيون الأمونيوم يعمل كحمض ضعيف ويمنح بروتونًا (H+) لجزيئات الماء.
س: ما هي صيغة كلوريد الأمونيوم؟
ج: صيغة كلوريد الأمونيوم هي NH4Cl. وهو يتألف من أيون الأمونيوم (NH4+) وأيون الكلوريد (Cl-) المرتبطين ببعضهما بواسطة روابط أيونية.
س: هل يذوب كلوريد الأمونيوم في الماء؟
ج: نعم، كلوريد الأمونيوم قابل للذوبان بدرجة عالية في الماء. في درجة حرارة الغرفة، يمكن أن يذوب حوالي 29.7 جرامًا من كلوريد الأمونيوم في 100 ملليلتر من الماء.
س: كيفية فصل كلوريد الأمونيوم وكلوريد الصوديوم؟
ج: إحدى طرق فصل كلوريد الأمونيوم وكلوريد الصوديوم هي التسامي. ويمكن تحقيق ذلك عن طريق تسخين الخليط، مما يؤدي إلى تسامي كلوريد الأمونيوم بينما يبقى كلوريد الصوديوم في شكل صلب. يمكن بعد ذلك جمع كلوريد الأمونيوم المتسامي وإعادة تكثيفه إلى شكل صلب. هناك طريقة أخرى تتمثل في إذابة الخليط في الماء ثم ترسيب أحد الأملاح بشكل انتقائي باستخدام كاشف محدد أو تعديل الرقم الهيدروجيني.
