بوروهيدريد الصوديوم (NaBH4) هو مسحوق بلوري أبيض يستخدم كعامل اختزال في التخليق العضوي وكمصدر للهيدروجين لخلايا الوقود. وهو شديد التفاعل وحساس للماء.
| اسم الأيوباك | رباعي هيدروبورات الصوديوم |
| الصيغة الجزيئية | NaBH4 |
| CAS رقم | 16940-66-2 |
| المرادفات | بوروهيدريد الصوديوم، رباعي هيدروبورات الصوديوم، هيدرات بوروهيدريد الصوديوم، هيدرات رباعي هيدروبورات الصوديوم |
| إنتشي | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
خصائص بوروهيدريد الصوديوم
نقطة غليان بوروهيدريد الصوديوم
ليس لدى بوروهيدريد الصوديوم نقطة غليان محددة جيدًا لأنه يتحلل عند تسخينه. تعتمد درجة حرارة التحلل على درجة الحرارة وظروف الضغط.
نقطة انصهار بوروهيدريد الصوديوم
بوروهيدريد الصوديوم لديه نقطة انصهار من 240 إلى 242 درجة مئوية. عند درجة الحرارة هذه، يتغير الشكل الصلب لـ NaBH4 إلى الحالة السائلة.
كثافة بوروهيدريد الصوديوم جم/مل
تبلغ كثافة بوروهيدريد الصوديوم 1.33 جم / مل. وهي مادة صلبة بلورية بيضاء اللون كثيفة نسبيًا مقارنة بالمواد الأخرى.
الكتلة المولية لبوروهيدريد الصوديوم
الكتلة المولية لبوروهيدريد الصوديوم (NaBH4) هي 37.83 جم/مول. ويتم حسابه عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في الصيغة الجزيئية لـ NaBH4 (ذرة صوديوم واحدة، ذرة بورون واحدة و4 ذرات هيدروجين).
الوزن الجزيئي لبوروهيدريد الصوديوم
الوزن الجزيئي لبوروهيدريد الصوديوم هو 37.83 جم / مول. هذا هو مجموع الكتل الذرية للذرات الفردية في الصيغة الجزيئية لـ NaBH4.
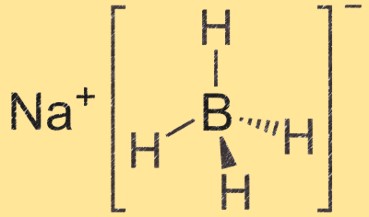
هيكل بوروهيدريد الصوديوم
بوروهيدريد الصوديوم هو جزيء رباعي السطوح مع أيون الصوديوم في المركز وأربع مجموعات هيدريد البورون متصلة به. ترتبط ذرة البورون بأربع ذرات هيدروجين لتكوين هيكل رباعي السطوح.
صيغة بوروهيدريد الصوديوم
الصيغة الكيميائية لرباعي هيدروبورات الصوديوم هي NaBH4. وتتكون من ذرة صوديوم واحدة (Na)، وذرة بورون واحدة (B) وأربع ذرات هيدروجين (H). تمثل هذه الصيغة التركيب الكيميائي لهذه المادة وتركيبها العنصري.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 1.33 جرام/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 37.83 جرام/مول |
| كثافة | 1.33 جرام/مل |
| نقطة الانصهار | 240-242 درجة مئوية |
| نقطة الغليان | يتحلل عند التسخين |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يذوب في الماء |
| الذوبان | قابل للذوبان في المذيبات العضوية |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر بوروهيدريد الصوديوم
رباعي هيدروبورات الصوديوم قابل للاشتعال ويتفاعل مع الماء. يمكنه إطلاق غاز الهيدروجين القابل للاشتعال وتكوين مخاليط متفجرة مع الهواء. رباعي هيدروبورات الصوديوم هو أيضًا مهيج للجلد والعين. يجب استخدام التهوية الكافية ومعدات الحماية الشخصية لتقليل التعرض عند التعامل مع رباعي هيدروبورات الصوديوم. قم بتخزينه في مكان بارد وجاف، بعيدًا عن مصادر الاشتعال والماء.
| رموز الخطر | قابلة للاشتعال، ومهيجة |
| وصف الأمان | س26، س36/37 |
| أرقام تعريف الأمم المتحدة | UN3375 |
| رمز النظام المنسق | 2827.90.90 |
| فئة الخطر | 4.3 |
| مجموعة التعبئة | ثانيا |
| تسمم | سامة إلى حد ما عن طريق الابتلاع والاستنشاق وملامسة الجلد |
طرق تخليق بوروهيدريد الصوديوم
يمكن تصنيع بوروهيدريد الصوديوم (NaBH4) بعدة طرق، منها:
- اختزال الصوديوم المعدني: تتضمن هذه الطريقة اختزال ثالث أكسيد البورون (B2O3) مع الصوديوم المعدني لإنتاج NaBH4.
- اختزال هيدريد الصوديوم: يمكن استخدام هيدريد الصوديوم (NaH) لتقليل ثلاثي هاليدات البورون لإنتاج NaBH4.
- تخفيض هيدريد ألومنيوم الليثيوم: يمكن استخدام هيدريد ألومنيوم الليثيوم (LiAlH4) لتقليل هاليدات البورون لإنتاج NaBH4.
- الهدرجة: يمكن تصنيع بوروهيدريد الصوديوم عن طريق هدرجة بوروهيدريد الصوديوم (NaBH3H).
يجب على المعدات المتخصصة والموظفين المدربين في بيئة جيدة التهوية تنفيذ جميع هذه الطرق لأن رباعي هيدروبورات الصوديوم قابل للاشتعال ويتفاعل. تعتمد طريقة التوليف المختارة على العائد المطلوب، والنقاء، واعتبارات التكلفة.
استخدامات بوروهيدريد الصوديوم
يعتبر رباعي هيدروبورات الصوديوم (NaBH4) عامل اختزال متعدد الاستخدامات وله نطاق واسع من التطبيقات في مختلف المجالات. بعض الاستخدامات الشائعة لرباعي هيدروبورات الصوديوم هي:
- التخليق العضوي: يستخدم NaBH4 في اختزال مركبات الكربونيل والاسترات والنيتريل والأميدات إلى الكحوليات والألدهيدات والأمينات المقابلة لها.
- المستحضرات الصيدلانية: يستخدم رباعي هيدروبورات الصوديوم في تخليق المكونات الصيدلانية النشطة المختلفة وفي تحضير المركبات اللولبية.
- علوم البوليمرات: يستخدم NaBH4 في تقليل راتنجات الإيبوكسي وراتنجات البوليستر غير المشبعة.
- البيئة: يمكن استخدام رباعي هيدروبورات الصوديوم في معالجة مياه الصرف الصحي لتقليل الملوثات مثل المعادن الثقيلة والأصباغ.
- صناعة الأغذية: يستخدم NaBH4 كعامل اختزال في إنتاج الأطعمة قليلة الدسم والآيس كريم والشوكولاتة.
بشكل عام، أثبت رباعي هيدروبورات الصوديوم أنه أداة قيمة في مجال التخليق الكيميائي نظرًا لخصائصه الاختزالية المعتدلة وقدرته على تقليل المجموعات الوظيفية بشكل انتقائي في الهياكل الجزيئية المعقدة.
أسئلة:
أي من هذه المركبات يمكن اختزاله بواسطة بوروهيدريد الصوديوم؟ تحقق من كل ما ينطبق.
يمكن لرباعي هيدروبورات الصوديوم (NaBH4) تقليل مجموعة واسعة من المركبات، بما في ذلك:
- مركبات الكربونيل، مثل الألدهيدات والكيتونات
- النتريل
- استرات
- أميدات
- راتنجات الايبوكسي
- راتنجات البوليستر غير المشبعة
- صبغات معينة
- معادن ثقيلة
- مركبات كيرالية
من المهم ملاحظة أن الظروف المحددة ومعلمات التفاعل يمكن أن تؤثر على كفاءة التخفيض وانتقائية عملية التخفيض. بالإضافة إلى ذلك، ليست كل المركبات مناسبة للاختزال باستخدام رباعي هيدروبورات الصوديوم، حيث أن بعضها قد يتعرض لتفاعلات جانبية غير مرغوب فيها.
لماذا من المهم تعريض بوروهيدريد الصوديوم للرطوبة؟
يعد تعرض رباعي هيدروبورات الصوديوم (NaBH4) للرطوبة أمرًا مهمًا لعدة أسباب:
- التفاعلية: رباعي هيدروبورات الصوديوم شديد التفاعل ويمكن أن يتحلل بسرعة في وجود الرطوبة، ويولد غاز الهيدروجين والحرارة. قد يشكل هذا خطر الانفجار والحرائق إذا لم يتم التعامل معه بشكل صحيح.
- التحلل المائي: يتحلل رباعي هيدروبورات الصوديوم بسهولة في وجود الرطوبة لتكوين هيدرات رباعي هيدروبورات الصوديوم (NaBH4.xH2O)، مما يقلل من خصائص الاختزال مقارنة بالشكل اللامائي.
- استقرار التخزين: يمكن أن تتسبب الرطوبة في تحلل رباعي هيدروبورات الصوديوم تدريجيًا، مما يقلل من مدة صلاحيته وفعاليته كعامل اختزال.
لذلك، من المهم تخزين بوروهيدريد الصوديوم في حاوية جافة محكمة الإغلاق والتعامل معه في بيئة جيدة التهوية لتقليل التعرض للرطوبة. إذا كان التعرض للرطوبة أمرًا لا مفر منه، فإن استخدام عوامل إزالة الرطوبة أو الأجواء الواقية يمكن أن يساعد في تقليل آثاره على استقرار وتفاعل رباعي هيدروبورات الصوديوم.
هل بوروهيدريد الصوديوم محفز؟
لا يعتبر رباعي هيدروبورات الصوديوم (NaBH4) عمومًا محفزًا، بل عامل اختزال. المحفز هو مادة تعمل على تسريع التفاعل الكيميائي دون أن تخضع نفسها لتغيير دائم. يتغير رباعي هيدروبورات الصوديوم كيميائيًا عند اختزاله، حيث يتم استهلاكه في تفاعل الاختزال.
تستخدم تفاعلات التخليق والاختزال العضوي عادةً رباعي هيدروبورات الصوديوم كمصدر لأيونات الهيدريد (H-). يقوم رباعي هيدروبورات الصوديوم بنقل أيونات الهيدريد هذه إلى جزيء الركيزة، وبالتالي تقليل المجموعات الوظيفية مثل الكربونيل والنيتريل والإسترات. على الرغم من دوره كعامل اختزال، يمكن لرباعي هيدروبورات الصوديوم أن يلعب دورًا ثانويًا كمستقبل للبروتون، مما يجعله قاعدة خفيفة يمكن أن تؤثر على ظروف التفاعل وتؤثر على نتيجة التفاعل.
ما الغاز القابل للاشتعال الناتج عن خلط بوروهيدريد الصوديوم مع الماء؟
إذا تم خلط رباعي هيدروبورات الصوديوم (NaBH4) مع الماء، فإنه يخضع للتحلل المائي السريع لتكوين بوروهيدريد الصوديوم المائي (NaBH4.xH2O) وغاز الهيدروجين. غاز الهيدروجين الناتج قابل للاشتعال وقد يسبب انفجارًا أو خطر الحريق إذا لم يتم التعامل معه بشكل صحيح.
يمكن أن يكون التفاعل بين رباعي هيدروبورات الصوديوم والماء طاردًا للحرارة ويولد الحرارة، مما قد يؤدي إلى تسريع معدل التحلل المائي وزيادة إطلاق غاز الهيدروجين. يمكن أن يؤدي التفاعل أيضًا إلى توليد كمية كبيرة من الغاز في وقت قصير، مما يخلق خطر الضغط الزائد والانفجار.
ولذلك، فمن المهم التعامل مع رباعي هيدروبورات الصوديوم في بيئة جيدة التهوية وتجنب تعريضه للرطوبة أو الماء. إذا كان التعرض للرطوبة أمرًا لا مفر منه، فإن استخدام عوامل إزالة الرطوبة أو الأجواء الواقية يمكن أن يساعد في تقليل معدل التحلل المائي وإطلاق غاز الهيدروجين.
ما عدد مولات الكافور التي تتفاعل مع بوروهيدريد الصوديوم؟
يعتمد عدد مولات الكافور التي ستتفاعل مع رباعي هيدروبورات الصوديوم (NaBH4) على عدة عوامل، بما في ذلك قياس العناصر الكيميائية للتفاعل، وتركيز ونقاء المواد المتفاعلة، وظروف التفاعل. يمكن تحديد قياس العناصر الكيميائية للتفاعل من المعادلة الكيميائية لاختزال الكافور إلى إيزوبورنيول باستخدام رباعي هيدروبورات الصوديوم:
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
وفقًا للمعادلة، يتفاعل مول واحد من الكافور مع 4 مولات من رباعي هيدروبورات الصوديوم. الكمية الفعلية من الكافور التي سوف تتفاعل مع كمية معينة من NaBH4 سوف تعتمد على تركيز ونقاء المواد المتفاعلة، وكذلك ظروف التفاعل مثل درجة الحرارة، والوقت، والمحفز.
لذلك، بدون معلومات أكثر دقة، ليس من الممكن تحديد العدد الدقيق لشامات الكافور التي ستتفاعل مع رباعي هيدروبورات الصوديوم.
