أكسيد الأمونيوم ((NH4)2O) مركب بلوري أبيض قابل للذوبان في الماء ويعمل كقاعدة ضعيفة. يتم إنتاجه عن طريق تفاعل الأمونيا والأكسجين ويستخدم في الأسمدة ومواد التنظيف وطفاية الحريق.
| اسم الأيوباك | أكسيد الأمونيوم |
| الصيغة الجزيئية | (NH4)2O |
| CAS رقم | 12046-03-6 |
| المرادفات | هيدروكسيد الأمونيوم، محلول الأمونيا، الأمونيا المائية |
| إنتشي | InChI=1S/H4N.O/h1H4;/q+1;-1 |
خصائص أكسيد الأمونيوم
صيغة أكسيد الأمونيوم
صيغة أكسيد الأمونيوم هي (NH4)2O. وهو مركب يتكون من ذرة نيتروجين واحدة وأربع ذرات هيدروجين مدمجة مع ذرة أكسجين واحدة.
الكتلة المولية لأكسيد الأمونيوم
تبلغ الكتلة المولية لأكسيد الأمونيوم حوالي 52.07 جرامًا لكل مول. ويتم حسابه عن طريق إضافة الأوزان الذرية لجميع الذرات الموجودة في الجزيء. تساعد الكتلة المولية على تحديد عدد الجزيئات الموجودة في كمية معينة من المادة.
نقطة غليان أكسيد الأمونيوم
تبلغ درجة غليان (NH4)2O حوالي 90 درجة مئوية. هي درجة الحرارة التي يتساوى عندها ضغط بخار السائل مع الضغط المحيط به، مما يؤدي إلى تحول السائل إلى غاز. تعتبر نقطة غليان المادة خاصية فيزيائية مهمة يمكن استخدامها لتحديد وتمييز المركبات المختلفة.
نقطة انصهار أكسيد الأمونيوم
تبلغ نقطة انصهار (NH4)2O حوالي -6 درجة مئوية. هذه هي درجة الحرارة التي تتحول عندها المادة الصلبة إلى سائل. يمكن استخدام نقطة انصهار المادة لتحديد وتمييز المركبات المختلفة، وكذلك لتحديد درجة نقاء المادة.
كثافة أكسيد الأمونيوم جم/مل
تبلغ كثافة (NH4)2O حوالي 1.02 جم / مل. الكثافة هي مقدار الكتلة لكل وحدة حجم وهي خاصية فيزيائية أساسية للمادة. يمكن استخدام كثافة المادة لتحديد وتمييز المركبات المختلفة، وكذلك لتحديد درجة نقاء المادة.
الوزن الجزيئي لأكسيد الأمونيوم
يبلغ الوزن الجزيئي لأكسيد الأمونيوم حوالي 52.07 جم / مول. هو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء المادة. يمكن استخدام الوزن الجزيئي لحساب مولات المادة الموجودة في كتلة معينة، وهو خاصية فيزيائية مهمة تستخدم في العديد من مجالات العلوم.
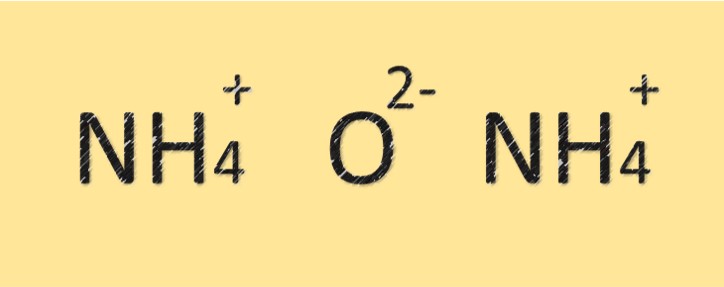
هيكل أكسيد الأمونيوم
أكسيد الأمونيوم مركب يتكون من ذرات النيتروجين والأكسجين. له الصيغة الجزيئية (NH4)2O ويتكون من ذرتين نيتروجين وذرة أكسجين واحدة. ترتبط ذرة النيتروجين بذرة الأكسجين برابطة تساهمية ولها أيضًا شحنة موجبة. يمتلك المركب صفة قاعدية أو قلوية بسبب وجود أيون الأمونيوم.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.02 جم/سم3 |
| لون | أبيض |
| يشم | الأمونيا |
| الكتلة المولية | 52.07 جرام/مول |
| كثافة | 1.02 جم/سم3 |
| نقطة الانصهار | -6 درجة مئوية |
| نقطة الغليان | 90 درجة مئوية |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | يذوب في الماء |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | 11.6 (100 جم/لتر، H2O، 20 درجة مئوية) |
السلامة ومخاطر أكسيد الأمونيوم
(NH4)2O مهيج للعينين والجلد والجهاز التنفسي. استنشاق أبخرةه قد يسبب السعال وضيق التنفس وتهيج الرئة. ملامسة الجلد قد تسبب الحكة والاحمرار. يجب التعامل مع المركب بحذر ويجب استخدام التدابير الوقائية مثل القفازات وحماية العين. في حالة التعرض لها، يجب شطف المناطق المصابة بالماء ويجب طلب الرعاية الطبية إذا استمرت الأعراض. كما أنه قابل للاشتعال ويجب إبعاده عن مصادر الاشتعال.
| رموز الخطر | مهيج |
| وصف الأمان | S26-S36/37/39 |
| أرقام تعريف الأمم المتحدة | UN2672 |
| رمز النظام المنسق | 2841.90.90 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | مهيجة للعيون والجلد والجهاز التنفسي |
طرق تصنيع أكسيد الأمونيوم
يمكن تصنيع (NH4)2O بعدة طرق، بما في ذلك التحلل الحراري لنترات الأمونيوم والتفاعل بين غاز الأمونيا وغاز الأكسجين.
تتضمن إحدى الطرق التحلل الحراري لنترات الأمونيوم، وهو سماد شائع. وينتج عن التفاعل الأمونيا وثاني أكسيد النيتروجين، والتي يتم أكسدتها بعد ذلك إلى ثاني أكسيد النيتروجين وأكسيد النيتريك. يتفاعل أكسيد النيتريك مع كمية أكبر من غاز الأمونيا لتكوين (NH4)2O.
تتضمن الطريقة الأخرى تمرير غاز الأمونيا فوق محفز ساخن، مما يؤدي إلى اندماج ذرات النيتروجين والأكسجين وتكوين (NH4)2O. كلا الطريقتين تنتجان (NH4)2O كمادة صلبة بلورية بيضاء، والتي يمكن تنقيتها عن طريق إعادة البلورة.
استخدامات أكسيد الأمونيوم
تستخدم الصناعات (NH4)2O لأغراض مختلفة بسبب محتواه العالي من الأمونيوم وخصائصه القلوية القوية. كسماد، فهو يوفر مصدرا للنيتروجين للنباتات. تستخدمه عوامل التنظيف لإذابة الشحوم والأوساخ. وتستخدمه صناعة المعادن كعامل اختزال لأكاسيد المعادن، وخاصة في إنتاج الألومنيوم. كمبرد، يتم استخدامه في أنظمة التبريد الصناعية وكمصدر للنيتروجين في إنتاج حمض النيتريك. وفي المختبر، يستخدمه الكيميائيون كمصدر للأمونيا في التفاعلات الكيميائية. إن تعدد استخدامات (NH4)2O يجعلها مادة كيميائية قيمة ذات تطبيقات متعددة في جميع القطاعات.
