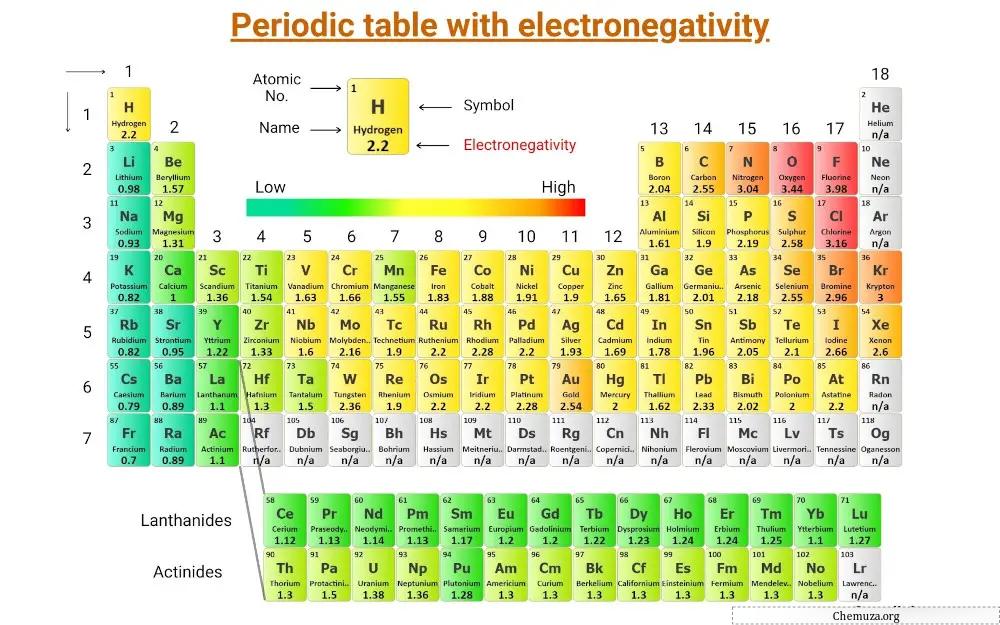
هذا هو الجدول الدوري الذي يتم فيه تسجيل السالبية الكهربية للعناصر.
(ملاحظة: السالبية الكهربية ليس لها وحدة. كان لينوس بولينج عالمًا صمم مقياس السالبية الكهربية الذي يرتب العناصر بالنسبة لبعضها البعض. ويعرف هذا المقياس بمقياس السالبية الكهربية بولينج.) [1]
إذا كنت لا تعرف ما هي السالبية الكهربية، فإليك شرحًا موجزًا عنها.
ما هي السالبية الكهربية؟
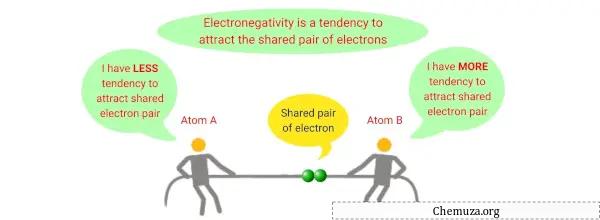
السالبية الكهربية هي خاصية كيميائية تصف قدرة الذرة على جذب الإلكترونات نحو نفسها عندما تكون جزءًا من مركب أو جزيء.
وهو مقياس للتجاذب النسبي الذي تمارسه الذرة على الإلكترونات المشتركة في الرابطة التساهمية .
لماذا تعتبر السالبية الكهربية مهمة؟
تلعب السالبية الكهربية دورًا حاسمًا في التنبؤ بطبيعة الروابط الكيميائية والتفاعلية والخواص الفيزيائية للجزيئات .
ويساعد هذا في تفسير سبب ميل عناصر معينة إلى تكوين أنواع محددة من الروابط، مثل الروابط التساهمية أو الأيونية، وكيف تؤثر هذه الروابط على سلوك المركب الناتج.
تساعد السالبية الكهربية أيضًا على التنبؤ بقطبية الجزيء وتفاعلاته مع الجزيئات الأخرى، وهو أمر مهم في العديد من المجالات، بما في ذلك الكيمياء والبيولوجيا وعلوم المواد.
ماذا يعني ارتفاع السالبية الكهربية؟
عندما تتمتع الذرة بسالبية كهربية أعلى، فهذا يعني أن لديها قدرة أكبر على جذب الإلكترونات إلى نفسها عندما تكون جزءًا من مركب كيميائي أو جزيء.
ويؤدي هذا إلى تكوين روابط تساهمية قطبية، حيث لا يتم تقاسم الإلكترونات بالتساوي بين الذرات.
الذرة ذات السالبية الكهربية الأعلى تجذب الإلكترونات الأقرب إليها، مما يؤدي إلى شحنة سالبة جزئية، في حين أن الذرة الأخرى في الرابطة لها شحنة موجبة جزئية.
وتؤثر هذه القطبية على الخواص الفيزيائية والكيميائية للمركب، مثل نقاط الغليان والانصهار، والذوبان، والتفاعلية.
من أمثلة العناصر ذات السالبية الكهربية العالية الفلور والأكسجين والنيتروجين.
