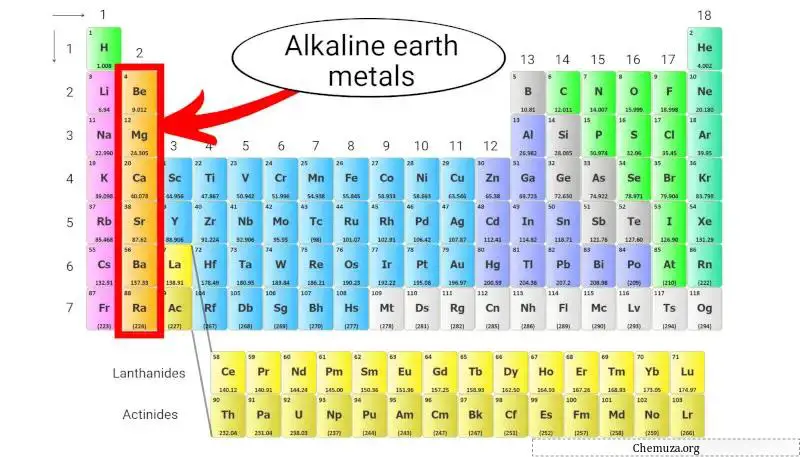
الفلزات القلوية الترابية هي مجموعة من العناصر الموجودة في العمود الثاني من الجدول الدوري . وهي تشمل البريليوم (Be)، والمغنيسيوم (Mg)، والكالسيوم (Ca)، والسترونتيوم (Sr)، والباريوم (Ba)، والراديوم (Ra).
تحتوي هذه المعادن على إلكترونين في غلافها الخارجي، [1] مما يجعلها متفاعلة كيميائيًا ولكنها ليست متفاعلة مثل الفلزات القلوية الموجودة في العمود الأول.
دعونا نستكشف المزيد عن المعادن الأرضية القلوية في الجدول الدوري.
ما هي المعادن الأرضية القلوية؟

المعادن الأرضية القلوية هي جزء من المجموعة 2 من الجدول الدوري ولها خاصيتين محددتين.
- عندما تتفاعل مع الماء، فإنها تنتج هيدروكسيدات قلوية أو قاعدية بطبيعتها.
- توجد معادن الأكسيد الخاصة بها (BeO، والمغنسيت، وMgO، والبريل، وما إلى ذلك) بشكل رئيسي في القشرة الأرضية وهي مستقرة للحرارة.
توضيح
عندما تتفاعل الفلزات القلوية الترابية (Mg، Ca، Sr، Ba و Ra) مع الماء، فإنها تشكل هيدروكسيدات قلوية (أو أساسية) بطبيعتها. [2]
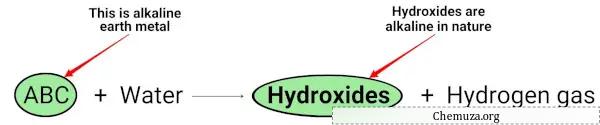
يمكنك أن ترى في المعادلة الكيميائية أعلاه أن الفلزات القلوية تعطي هيدروكسيدات أساسية بطبيعتها (لها درجة حموضة أكبر من 7) وتطلق غاز الهيدروجين.
على سبيل المثال:
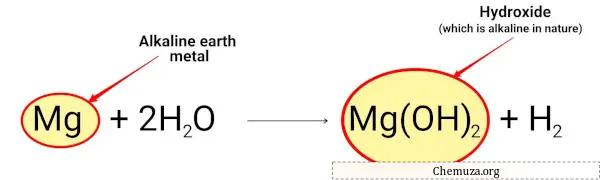
يتفاعل المغنيسيوم مع الماء ويشكل هيدروكسيد المغنيسيوم وهو قلوي بطبيعته.
بالإضافة إلى ذلك، توجد هذه المعادن بشكل أساسي في القشرة الأرضية (على شكل أكاسيد) وهذه المعادن المؤكسدة مقاومة للحرارة. [2]
وهذان المعياران يعطيان لهذه المعادن اسمها “المعادن الأرضية القلوية”.
(ملاحظة: من المهم ملاحظة أن البريليوم، وهو أيضًا أحد عناصر المجموعة 2، لا يشكل محلولًا قلويًا عندما يتفاعل مع الماء. وبدلاً من ذلك، تُظهر هيدروكسيداته سلوكًا مذبذبًا، مما يعني أنها يمكن أن تتصرف مثل حمض أو قاعدة ولذلك لا يعتبر البريليوم فلزاً قلوياً ترابياً رغم أنه ينتمي إلى نفس المجموعة.)
ما هو القاسم المشترك بين جميع المعادن الأرضية القلوية؟
تشترك المعادن الأرضية القلوية في عدة سمات مشتركة.
على سبيل المثال، يحتوي كلاهما على إلكترونين تكافؤ في مستوى الطاقة الخارجي لهما، مما يجعلهما متفاعلين تمامًا.
يرجع هذا التفاعل إلى الميل إلى فقدان هذه الإلكترونات أثناء التفاعلات الكيميائية، مما يؤدي إلى تكوين كاتيونات ذات شحنة +2.
بالإضافة إلى ذلك، تتمتع جميع الفلزات القلوية الأرضية بمظهر أبيض فضي لامع.

إذن هذان هما الشيئان الرئيسيان المشتركان بين الفلزات القلوية الأرضية.
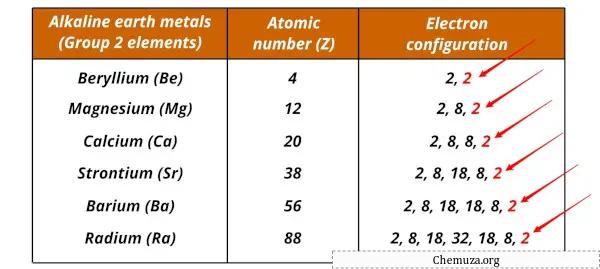
قائمة الفلزات القلوية وتكويناتها الإلكترونية
المعادن الأرضية القلوية وتكويناتها الإلكترونية موضحة أدناه.
| عنصر | التكوين الإلكترونية |
| البريليوم (كن) | [هو] 2س 2 |
| المغنيسيوم (ملغ) | [افعل] 3ث 2 |
| الكالسيوم (كاليفورنيا) | [ع] 4س 2 |
| السترونتيوم (ريال سعودي) | [كر] 5S 2 |
| الباريوم (با) | [Xe] 6س 2 |
| الراديوم (رع) | [آر إن] 7س 2 |
الاتجاهات الدورية في المعادن الأرضية القلوية
عندما يتحرك المرء إلى أسفل مجموعة المعادن الأرضية القلوية في الجدول الدوري، يمكن ملاحظة الاتجاهات التالية:
- التكافؤ: جميع الفلزات القلوية الأرضية لها نفس التكافؤ +2. لذا، لا يوجد أي تغيير في التكافؤ مع نزولنا إلى أسفل المجموعة.
- الحجم الذري: يزداد الحجم الذري للمعادن القلوية الأرضية كلما نزول الفرد إلى أسفل المجموعة. وذلك لأن عدد الطبقات الإلكترونية (أو المدارات ) يزداد وتأثير التدريع للإلكترونات الداخلية يقلل من التجاذب بين النواة والإلكترونات الخارجية.
- الشخصية المعدنية: تزداد الشخصية المعدنية للمعادن الأرضية القلوية كلما تحرك الفرد إلى أسفل المجموعة. وذلك لأن الذرات تصبح أكبر حجمًا وتحتوي على المزيد من الإلكترونات، مما يجعلها أكثر قدرة على فقدان الإلكترونات وتكوين أيونات موجبة.
- السالبية الكهربية: تتناقص السالبية الكهربية للمعادن الأرضية القلوية مع نزولها إلى أسفل المجموعة. وذلك لأن الذرات تصبح أكبر حجمًا وتحتوي على عدد أكبر من الأغلفة الإلكترونية، مما يزيد من صعوبة جذب الإلكترونات إليها.
- الألفة الإلكترونية: الألفة الإلكترونية للمعادن القلوية الأرضية منخفضة بشكل عام وتتناقص كلما تحرك الشخص إلى أسفل المجموعة.
- طاقة التأين: تتناقص طاقة التأين للمعادن الأرضية القلوية مع نزول المجموعة إلى أسفل. وذلك لأن الذرات الأكبر حجمًا تحتوي على عدد أكبر من الإلكترونات، كما أن الإلكترونات الخارجية أبعد عن النواة، مما يسهل إزالتها.
ملخص
تشمل المعادن الأرضية القلوية البريليوم والمغنيسيوم والكالسيوم والسترونتيوم والباريوم والراديوم. تحتوي على إلكترونين في غلافها الخارجي، مما يجعلها متفاعلة ولكن أقل تفاعلاً من الفلزات القلوية.
تنتج هذه المعادن هيدروكسيدات قلوية عندما تتفاعل مع الماء وتحتوي على معادن مؤكسدة مقاومة للحرارة. الخصائص الرئيسية المشتركة بين جميع الفلزات القلوية الأرضية هي وجود إلكترونين تكافؤ، وهما أبيض فضي ولامع، وتشكل كاتيونات بشحنة +2.
يظل التكافؤ كما هو عندما يتحرك الشخص إلى أسفل المجموعة، لكن الحجم الذري والشخصية المعدنية يزدادان، بينما تنخفض السالبية الكهربية والألفة الإلكترونية وطاقة التأين.
