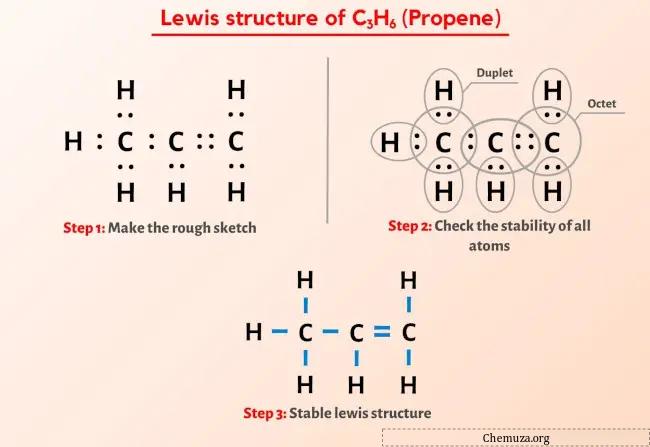
لقد رأيت الصورة أعلاه بالفعل، أليس كذلك؟
اسمحوا لي أن أشرح بإيجاز الصورة أعلاه.
يحتوي هيكل C3H6 (البروبين) لويس على ثلاث ذرات كربون (C) في المركز وهي محاطة بذرات الهيدروجين (H). يحتوي على ستة روابط CH، ورابطة CC واحدة، ورابطة C=C واحدة.
إذا لم تفهم أي شيء من الصورة أعلاه لبنية لويس لـ C3H6، فابق معي وستحصل على شرح تفصيلي خطوة بخطوة حول كيفية رسم بنية لويس لـ C3H6 .
لذلك دعونا ننتقل إلى خطوات رسم بنية لويس لـ C3H6.
خطوات رسم هيكل لويس C3H6
الخطوة 1: أوجد العدد الإجمالي لإلكترونات التكافؤ في جزيء C3H6
من أجل العثور على العدد الإجمالي لإلكترونات التكافؤ في جزيء C3H6، عليك أولا معرفة إلكترونات التكافؤ الموجودة في ذرة الكربون وكذلك ذرة الهيدروجين.
(إلكترونات التكافؤ هي الإلكترونات الموجودة في المدار الخارجي لأي ذرة).
سأخبرك هنا بكيفية العثور بسهولة على إلكترونات التكافؤ للكربون والهيدروجين باستخدام الجدول الدوري.
إجمالي إلكترونات التكافؤ في جزيء C3H6
→ إلكترونات التكافؤ المعطاة من ذرة الكربون:
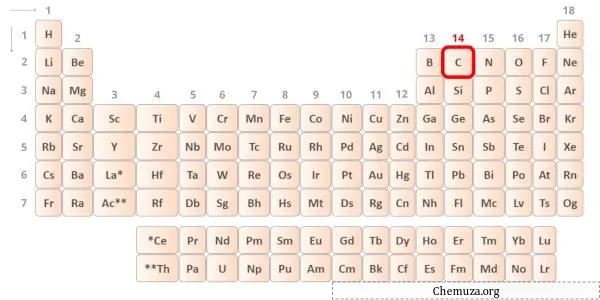
الكربون هو أحد عناصر المجموعة 14 من الجدول الدوري. [1] وبالتالي فإن إلكترونات التكافؤ الموجودة في الكربون هي 4 .
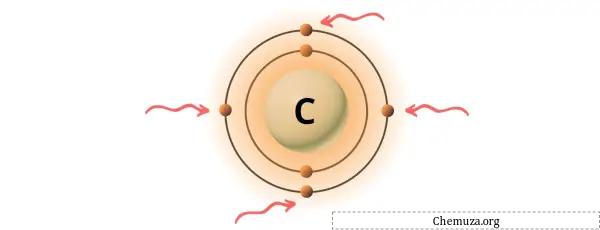
يمكنك رؤية إلكترونات التكافؤ الأربعة الموجودة في ذرة الكربون كما هو موضح في الصورة أعلاه.
→ إلكترونات التكافؤ المعطاة من ذرة الهيدروجين:
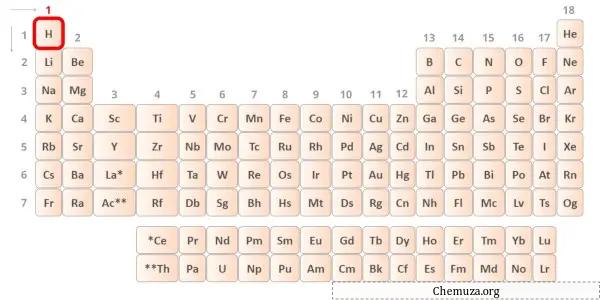
الهيدروجين هو عنصر المجموعة 1 في الجدول الدوري. [2] ولذلك فإن إلكترون التكافؤ الموجود في الهيدروجين هو 1 .

يمكنك أن ترى أن إلكترون تكافؤ واحد فقط موجود في ذرة الهيدروجين كما هو موضح في الصورة أعلاه.
لذا،
مجموع إلكترونات التكافؤ في جزيء C3H6 = إلكترونات التكافؤ الممنوحة من 3 ذرات كربون + إلكترونات التكافؤ المتبرع بها من 6 ذرات هيدروجين = 4(3) + 1(6) = 18 .
الخطوة 2: إعداد الرسم
يحتوي هيكل لويس من البروبين (C3H6) على ثلاث ذرات كربون متتالية مع رابطة واحدة ورابطة مزدوجة بين ذرات الكربون. ترتبط ذرات الهيدروجين بذرات الكربون لتشكل رابطة واحدة.
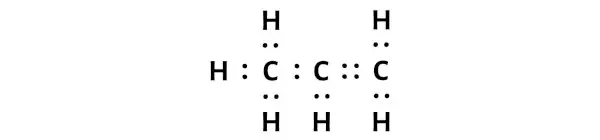
الخطوة 3: التحقق مما إذا كانت جميع الذرات مستقرة أم لا
في الرسم البياني أعلاه لجزيء C3H6، يمكنك أن ترى أن الذرات الخارجية هي ذرات الهيدروجين.
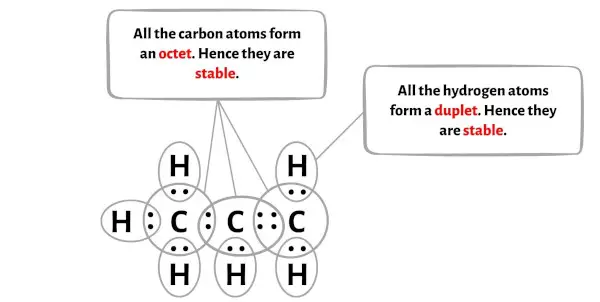
تشكل ذرات الهيدروجين الستة ثنائيًا وبالتالي فهي مستقرة.
بالإضافة إلى ذلك، تشكل ذرات الكربون الثلاث ثمانيًا، لذا فهي مستقرة أيضًا.
لذلك، فإن بنية لويس للبروبين (C3H6) المذكورة أعلاه هي بنية لويس مستقرة.
في بنية نقاط لويس هذه، يمكنك أيضًا تمثيل كل زوج من إلكترونات الترابط (:) كرابطة واحدة (|). سيؤدي القيام بذلك إلى تكوين بنية لويس التالية لـ C3H6.
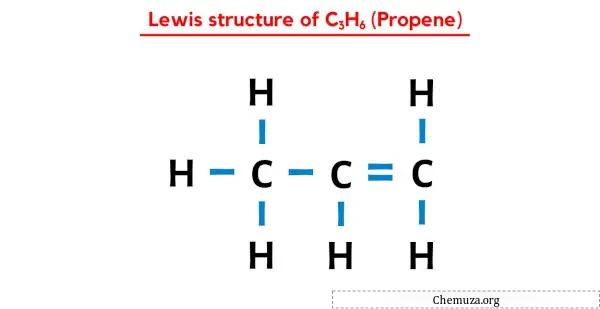
أتمنى أن تكون قد فهمت جميع الخطوات المذكورة أعلاه تمامًا.
لمزيد من التدريب والفهم الأفضل، يمكنك تجربة هياكل لويس الأخرى المدرجة أدناه.
جرب (أو على الأقل شاهد) هياكل لويس هذه لفهم أفضل:
