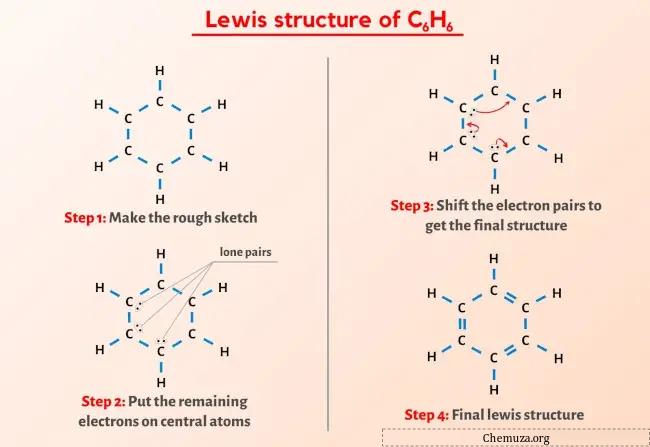
لقد رأيت الصورة أعلاه بالفعل، أليس كذلك؟
اسمحوا لي أن أشرح بإيجاز الصورة أعلاه.
يحتوي هيكل لويس C6H6 (البنزين) على 6 ذرات كربون (C) في هيكل على شكل حلقة وكل ذرة كربون مرتبطة بذرة هيدروجين (H). توجد روابط مزدوجة متناوبة في البنية الحلقية للكربون (C).
إذا لم تفهم أي شيء من الصورة أعلاه لبنية لويس لـ C6H6، فابق معي وستحصل على شرح تفصيلي خطوة بخطوة حول كيفية رسم بنية لويس لـ C6H6 .
لذلك دعونا ننتقل إلى خطوات رسم بنية لويس لـ C6H6 (البنزين).
خطوات رسم هيكل لويس C6H6
الخطوة 1: أوجد العدد الإجمالي لإلكترونات التكافؤ في جزيء C6H6
من أجل العثور على العدد الإجمالي لإلكترونات التكافؤ في جزيء C6H6، عليك أولاً معرفة إلكترونات التكافؤ الموجودة في ذرة الكربون وكذلك ذرة الهيدروجين.
(إلكترونات التكافؤ هي الإلكترونات الموجودة في المدار الخارجي لأي ذرة).
سأخبرك هنا بكيفية العثور بسهولة على إلكترونات التكافؤ للكربون والهيدروجين باستخدام الجدول الدوري.
إجمالي إلكترونات التكافؤ في جزيء C6H6
→ إلكترونات التكافؤ المعطاة من ذرة الكربون:
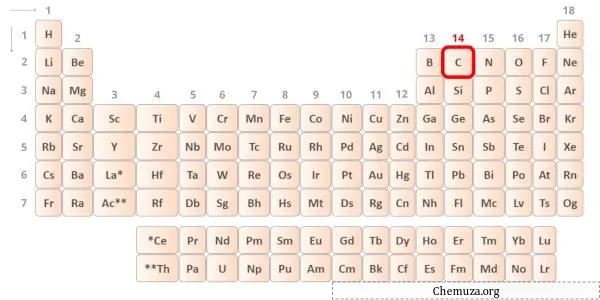
الكربون هو أحد عناصر المجموعة 14 من الجدول الدوري. [1] وبالتالي فإن إلكترونات التكافؤ الموجودة في الكربون هي 4 .
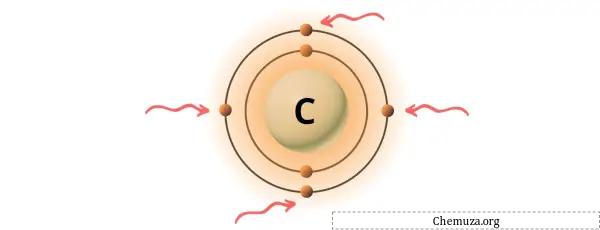
يمكنك رؤية إلكترونات التكافؤ الأربعة الموجودة في ذرة الكربون كما هو موضح في الصورة أعلاه.
→ إلكترونات التكافؤ المعطاة من ذرة الهيدروجين:
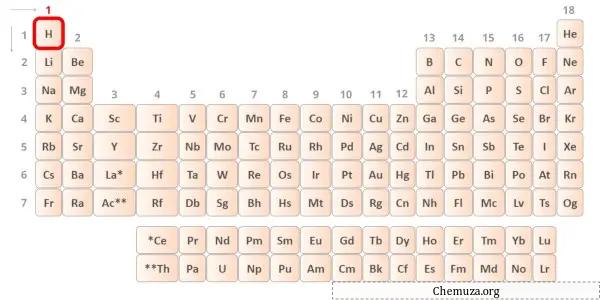
الهيدروجين هو عنصر المجموعة 1 في الجدول الدوري. [2] ولذلك فإن إلكترون التكافؤ الموجود في الهيدروجين هو 1 .

يمكنك أن ترى أن إلكترون تكافؤ واحد فقط موجود في ذرة الهيدروجين كما هو موضح في الصورة أعلاه.
لذا،
مجموع إلكترونات التكافؤ في جزيء C6H6 = إلكترونات التكافؤ المتبرع بها من 6 ذرات كربون + إلكترونات التكافؤ المتبرع بها من 6 ذرات هيدروجين = 4(6) + 1(6) = 30 .
الخطوة 2: إعداد الرسم
يحتوي هيكل لويس للبنزين (C6H6) على 6 ذرات كربون مرتبة في هيكل حلقي.
بالإضافة إلى ذلك، ترتبط كل ذرة من ذرات الكربون هذه بذرة هيدروجين واحدة.
لذا دعونا نرسم مخططًا يمثل حلقة مكونة من 6 ذرات كربون وذرات هيدروجين متصلة بكل ذرة كربون.
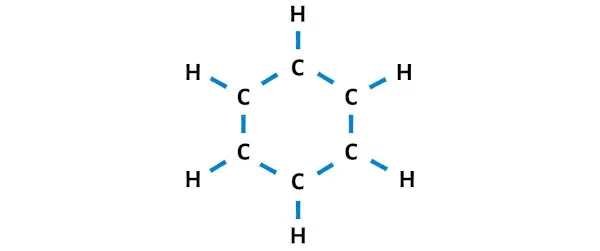
يوجد 12 رابطة فردية في الرسم أعلاه. لذلك، من إجمالي 30 إلكترونًا تكافؤًا، تم استخدام 24 إلكترونًا تكافؤًا في الرسم البياني أعلاه.
الخطوة 3: احتفظ بالإلكترونات المتبقية في الذرة المركزية
يمكنك أن ترى أنه في الخطوة 1 قمنا بحساب العدد الإجمالي لإلكترونات التكافؤ الموجودة في جزيء C6H6.
يحتوي جزيء C6H6 على إجمالي 30 إلكترونًا تكافؤًا ، ومن بينها، يُستخدم 24 إلكترونًا تكافؤ فقط في الرسم البياني أعلاه.
إذن عدد الإلكترونات المتبقية = 30 – 24 = 6 .
تحتاج إلى وضع هذه الإلكترونات الستة (أي 3 أزواج من الإلكترونات ) على ذرات الكربون في الرسم البياني أعلاه لجزيء C6H6.
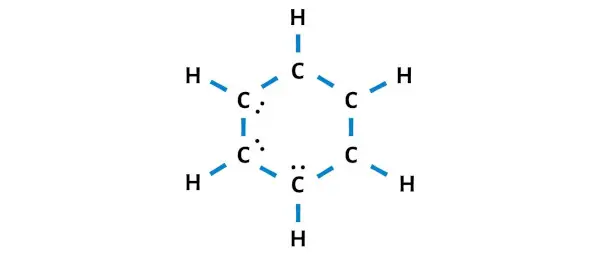
والآن دعنا ننتقل إلى الخطوة التالية.
الخطوة 4: جعل جميع الذرات مستقرة
من الرسم أعلاه يمكنك أن ترى أن ذرات الهيدروجين الخارجية تشكل ثنائيًا . ولذلك فهي مستقرة.
الآن، من بين ذرات الكربون الستة، لا تشكل ذرات الكربون الثلاث ثمانيًا .
لذلك نحن بحاجة إلى تحريك أزواج الإلكترونات بحيث يشكل كل الكربون ثمانيًا ويصبح مستقرًا.
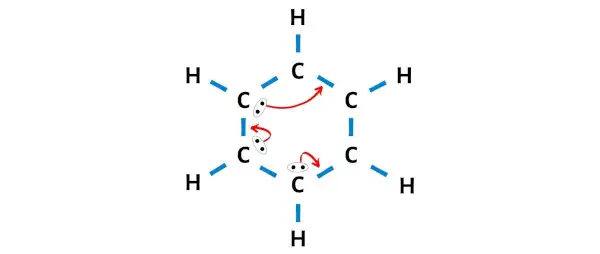
بعد تحريك أزواج الإلكترونات، يمكنك أن ترى أن ذرات الكربون الستة تشكل ثمانيًا وهي الآن مستقرة.
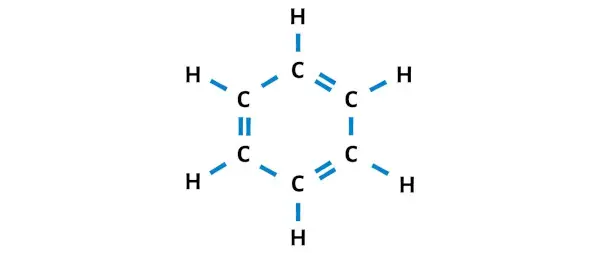
وبالتالي فإن هذا هو هيكل لويس المستقر للبنزين (أو C6H6).
أتمنى أن تكون قد فهمت جميع الخطوات المذكورة أعلاه تمامًا.
لمزيد من التدريب والفهم الأفضل، يمكنك تجربة هياكل لويس الأخرى المدرجة أدناه.
جرب (أو على الأقل شاهد) هياكل لويس هذه لفهم أفضل:
